 可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是

A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH- |
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓ |
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 |
D.电池工作时,电子通过外电路从正极流向负极 |
下列说法正确的是( )
①pH=2和pH=1的HNO3中c(H+)之比为1∶10
②0.2 mol·L-1与0.1 mol·L-1醋酸中,c(H+)之比大于2∶1
③Na2CO3溶液中c(Na+)与c(CO32-)之比为2∶1
④纯水在100 ℃和20 ℃时,pH前者大
⑤同温时,pH=10的KOH溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
⑥100 mL 0.1 mol·L-1的醋酸与10 mL 1.0 mol·L-1的醋酸中H+的数目,前者多
| A.①④⑤ | B.①⑤⑥ | C.①②⑤ | D.①②③⑥ |
下列说法正确的是( )
| A.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| B.25 ℃、101 kPa时,1 mol S和2 mol S的燃烧热相等 |
| C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 |
| D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 |
右图曲线a表示放热反应
X(g) + Y(g)  Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是 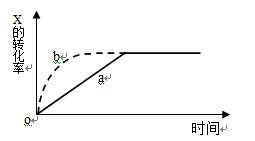
| A.升高温度 | B.加大X的投入量 |
| C.加催化剂 | D.增大体积 |
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。
HIn(aq) 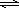 H++In-(aq)
H++In-(aq)
(红色) (黄色)
浓度为0.02mol/L的下列各溶液:
(1)HCl (2)石灰水 (3)NaCl(aq) (4)NaHSO4(aq) (5)NaHCO3(aq) (6)氨水(7)Na2O2粉末 ;其中能使指示剂显黄色的是
| A.(1)(4)(5) | B.(2)(5)(6) |
| C.(1)(4) | D.(2)(5)(6)(7) |
在其他条件一定时,对反应2A+B 2C(正反应放热),A的最大转化率与温度曲线如右图,下列叙述正确的是
2C(正反应放热),A的最大转化率与温度曲线如右图,下列叙述正确的是
| A.X或Y两点相应的V正≠V逆 |
B.X、Y两点均已到达平衡状态两点的反应速率均有V正=V逆 |
C.W点表示非平衡状态且V正>V逆 |
| D.相应点的反应速率大小:W>N>Y |