以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制。以粗盐为原料的“氯碱工业”流程如下: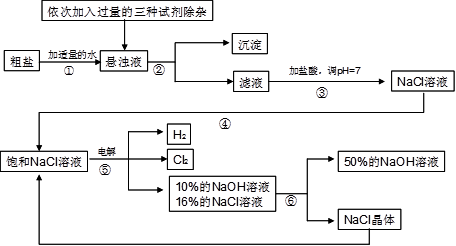
回答下列问题:
(1)氯气、氢氧化钠在工业上有广泛的用途。下列关于氢氧化钠的描述中,错误的是 。
| A.能去除油污,可做厨房清洁剂 | B.易溶于水,溶解时放出大量的热 |
| C.水溶液能使石蕊溶液变红 | D.可用作某些气体的干燥剂 |
(2)操作②的名称是 ,操作④的名称是 。
(3)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3溶液必须在BaCl2溶液之 (填“前”或“后”)加入。有同学提出用 溶液代替BaCl2溶液可达到同样的目的。
(4)电解饱和NaCl溶液的化学方程式是 。
(5)该流程中可以循环利用的物质是 。
请根据题意回答下列问题:[在下列⑴⑵两小题中任选一题回答,若两小题都回答,则以第⑴小题的答案评定分数。]
(1)检验氧化钙中是否存在碳酸钙。
(2)溶于雨水会形成酸雨的气体有哪些?酸雨对环境会造成哪些危害?(各答一种即可)
化学课上老师表演了一个小魔术——“无中生有”:相同条件下,向A、B两个体积相同的集气瓶中分别充满无色干燥的硫化氢(H2S)气体和二氧化硫气体。如图所示,抽开毛玻璃片,瓶口对紧,颠倒几次,使两种气体充分混合。一会儿,观察到两瓶内壁附着淡黄色固体颗粒,同时瓶壁上有小水珠出现。请根据现象回答下列问题: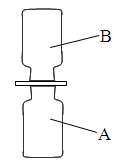
(1)上述反应的化学方程式为_________________.
(2)如果这两个瓶子是质地较软的塑料瓶,会观察到,原因是_______。
(3)已知:相同条件下,相等体积的气体所含的分子数目相等。反应完毕,瓶中剩余的气体为____________(填化学式)。
一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学,合成气可通过天然气的重整得到,如CH4+H2O═CO+3H2。合成气可制二甲醚,二甲醚被称为21世纪的新型燃料。合成气还可用于冶炼金属。请你仔细阅读合成气冶炼粗铜和制取二甲醚的部分生产流程,回答下列问题: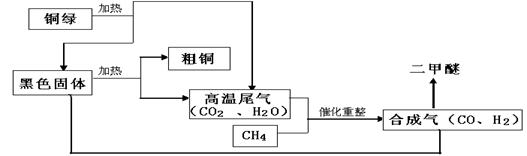
(1)铜绿[化学式为Cu2(OH)2CO3]是由种元素组成的化合物。合成气在与黑色固体冶炼粗铜的生产过程中发生的反应方程式为。(写出其中的一个反应)
(2)在催化重整反应中CH4起的作用是:。
(3)合成气(CO和H2)在不同催化剂的作用下,可以化合成不同的物质。仅用合成气为原料不可能得到的物质是 (填字母序号)。
A.草酸(H2C2O4) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
水是宝贵的自然资源,我们要认识它,爱护它。
(1)水是由______组成的,电解水的化学方程式是________
(2)硬水不利于我们的生活,生活中我们可以用____的方法将其软化
(3)请推荐你在生活中节约用水的一个好举措______
(4)自然界的水因含有多种杂质而不能直接饮用。需要经过自来水厂处理后才能饮用。目前很多自来水厂用氯气进行消毒。消毒过程中常会发生如下化学反应,其反应的微观过程可用下图表示:
若D的化学式为HClO,写出图甲所示反应的化学方程式。小军将新制的氯气通入紫色石蕊试液中,惊奇地发现试液先变红,接着就褪色了。他查阅资料得知新制的氯水具有漂白性。为探究溶液褪色的原因,他设计了几个实验:
【实验准备】用紫色石蕊试液浸泡几朵小纸花,并晾干;加热少量新制的氯水,冷却后灌入喷壶。
| 实验Ⅰ |
实验Ⅱ |
实验Ⅲ |
实验Ⅳ |
实验Ⅴ |
 喷稀盐酸 喷稀盐酸 |
 喷 水 |
 直接放入氯气 |
 喷水后放入氯气中 |
 喷加热后的氯水 |
【实验现象】①实验Ⅰ:_______________________ ②实验Ⅱ、Ⅲ:紫花不变色
③实验Ⅳ:紫花先变红后褪色 ④实验Ⅴ:紫花变红,不褪色
【实验结论】新制氯水中具有漂白性的物质是______________(写化学式)。
小军家的下水管道堵了。爸爸买回一种“管道通”,使用后堵塞的管道畅通无阻了。小军对此很好奇,于是想探究“管道通”中的物质成分。
【提出问题】“管道通”中的物质是什么?
【查阅资料】主要内容如下。
(1)下水管里的淤积物主要为油污、食物残渣、毛发等。
(2)氢氧化钠是强碱,能去除油污,腐蚀毛发一类的东西。常用于疏通管道。
(3)铝粉为银灰色固体。铝与酸、碱溶液都能反应放出氢气,反应时放出大量热。
①铝与盐酸反应的化学方程式是。
②铝与氢氧化钠溶液反应的化学方程式是2Al+2NaOH + ==2NaAlO2 +3H2↑
【猜想与验证】小军打开一盒“管道通”,内有一袋白色固体颗粒和一袋银灰色粉末。
(1)猜想:白色固体颗粒为氢氧化钠。
| 实验操作 |
实验现象 |
| ①将几粒白色固体颗粒放在表面皿上,放置一会儿。 |
。 |
| ②将几粒白色固体颗粒放入盛有少量水的试管中,并用手触摸试管外壁。 |
。 |
| ③向步骤②得到的溶液中放入一段羊毛线,加热一段时间。 |
羊毛线逐渐消失。 |
结论:白色固体颗粒为氢氧化钠。
(2)猜想:银灰色粉末为铝粉。
| 实验操作 |
实验现象 |
①按照下图安装两套仪器。 |
|
| ②两套仪器中分别依次加入银灰色粉末和稀盐酸;银灰色粉末和。 |
都产生大量无色气体,试管外壁温度明显升高。 |
| ③待导管口有气泡均匀持续冒出时,收集1试管气体,验纯。(两套仪器操作相同) |
验纯时的操作和现象:(两套仪器相同) 。 |
| ④在导管口点燃气体。(两套仪器操作相同) |
都产生淡蓝色火焰。 |
结论:银灰色粉末为铝粉。
【应用】使用管道通时,先将其中银灰色粉状固体添加于被堵塞的管道中,然后再加入白色固体颗粒,倒入一杯水,堵上管道口。一会儿,管道内发生化学反应。根据题目信息,推测管道内的反应现象是。
【反思】①老师告诉小军,氢氧化钾和氢氧化钠的性质非常相似。要确认猜想(1)是否正确,还需要学习如何检验钠元素的存在。
②根据本实验分析,使用“管道通”时,应注意的事项有(填一条即可)。