(Ⅰ)
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,
则甲醇燃烧的热化学方程式为 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1="+49.0" kJ·mol-1
②CH3OH(g)+ O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+ O2(g)===H2O(g) △H ="-241.8" kJ·mol-1
O2(g)===H2O(g) △H ="-241.8" kJ·mol-1
则反应②的△H2= kJ·mol-1。
(3)甲醇燃料电池的结构示意图如右。甲醇进入 极(填“正”或“负”),写出正极的电极反应式 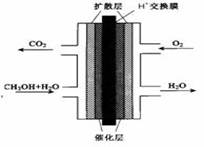
(Ⅱ)
铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原): 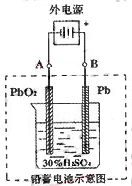
(1)放电时:正极的电极反应式是
电解液中H2SO4的浓度将变 ;
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成 B电极上生成
下列离子组一定能大量共存的是
| A.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ |
| B.石蕊呈蓝色的溶液中:Na+、NO3-、AlO2-、HCO3 - |
| C.含大量Al3+的溶液中:K+、NO3-、Na+、ClO- |
| D.含大量OH-的溶液中:CO32 -、Cl-、F-、K+ |
COCl2(g)  CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施 ①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施 ①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
除去括号内杂质的试剂或方法错误的是
| A.KNO3晶体(NaCl),蒸馏水,结晶 |
| B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 |
| C.HNO3溶液(H2SO4),适量BaCl2溶液,过滤 |
| D.C2H5OH(CH3COOH),加足量CaO,蒸馏 |
设NA为的值,下列叙述正确的是
| A.常温下,1L 0.1mol·L-1的NH4NO3溶液中氮原子数为0.2NA |
| B.1 mol羟基中电子数为10 NA |
| C.在反应KIO3+ 6HI =" KI" + 3I2 + 3H2O中,每生成3 mol I2 转移的电子数为6 NA |
| D.常温常压下,22.4L乙烯中C--H键数为4 NA |
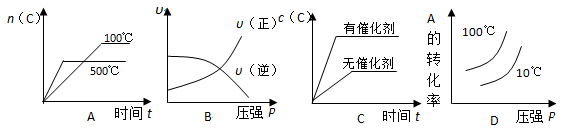
对于可逆反应: 2A(g)+B(g) 
 2C(g) △H<0,下列各图中正确的是
2C(g) △H<0,下列各图中正确的是