硫酸是一种实验室常用的化学试剂。请按要求填空:
(1)浓硫酸试剂瓶上适合贴上的图标是 (填写字母标号)。
(2)实验室有1.00mol·L-1的硫酸溶液,从中准确量出10.00 mL,其物质的量浓度为 mol·L-1。现将准确量出的10.00 mL的硫酸溶液配制成0.100mol·L-1的稀硫酸,所需要的玻璃仪器除烧杯、玻璃棒还需 和 。在配制过程中定容时俯视,则所配溶液浓度 (填“偏大”或“偏小”或“无影响”)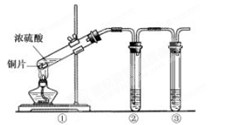
(3)用上图所示的实验装置②验证铜与浓硫酸反应生成的气体产物,则装置②、③中试剂依次为下列的 和
A.品红溶液 B.BaCl2溶液 C.NaOH溶液 D.AgNO3溶液
(4)装置①中发生反应的化学方程式为 若装置①中加入铜6.4g和含有0.2molH2SO4的浓硫酸,则产生二氧化硫质量
A.等于6.4克 B.大于6.4克 C.小于6.4克 D.不能确定
(5)若将装置①中的铜片换成木炭,装置②试管内为氢硫酸溶液, 装置③试管内为澄清石 灰水,则装置①中发生反应的化学方程式为 。装置②中主要反应的氧化剂和还原剂物质的量之比是 。根据装置③观察到有白色沉淀生成的现象 (填“能”或“不能”)判断该白色沉淀一定只有CaCO3。
(I)电子工业常用30%的FeCl3。溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式。
(2)检验溶液中Fe3+存在的试剂是
(Ⅱ)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。 (3)步骤①中发生反应的离子方程式
(3)步骤①中发生反应的离子方程式
(4)滤渣的主要成分是,(填化学式)。
(5)为了除去滤渣中的杂质得到铜,需加入的试剂A是(填化学式)。
在MgCl2溶液中滴加少量NaOH溶液,现象为_________________,在AlCl3溶液中滴加少量NaOH溶液,现象为____________,化学方程式_______________________,继续加入过量的NaOH溶液,现象为_________________________,化学方程式为 ___________________________。
测定硫酸铝晶体样品中Al2(SO4)3·18H2O(M=666g/mol)质量分数的实验步骤为(物质EDTA分别能与Al3+或Pb2+以物质的量之比1︰1进行反应):
步骤1:准确称取硫酸铝晶体样品m g,溶于25 mL水中。
步骤2:加入c1 mo1·L-1EDTA溶液V1mL(过量),煮沸、冷却,稀释至100 mL。
步骤3:取25. 00mL上述稀释液,测定得知:,当加入c2 mol·L-1Pb(NO3)2溶液V2mL 恰好与过量的EDTA溶液反应。
⑴步骤2中“稀释至100 mL”时,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
、。
⑵请根据上述数据计算该样品中Al2(SO4)3·18H2O的质量分数。(用含字母的代数式表示)。
⑶若将步骤1所得的溶液改为滴加4mol/L NaOH溶液(杂质不参与反应),当滴加到10mL时,溶液又恰好变澄清,求步骤1溶液中硫酸铝的物质的量浓度(用具体数值表示)。
(10分)实验室常用二氧化锰和浓盐酸反应制取氯气:MnO2+4HCl(浓) MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。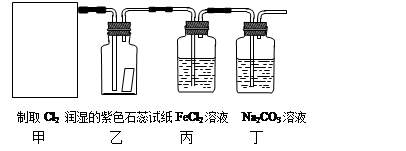
⑴在该实验中,甲部分的装置是(填写字母)。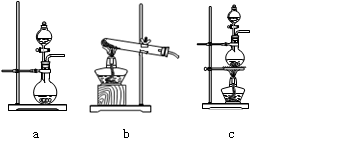
⑵乙装置中可观察到的颜色变化为:。
⑶丙装置中FeCl2溶液与Cl2反应的离子方程式是。
⑷丁装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是。
⑸该实验存在明显的缺陷,改进的方法是。
(12分)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
试回答下列问题:
⑴FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为;
证明蚀刻后的混合物溶液仍存在Fe3+的操作是:
。
⑵过程I加入铁屑的主要作用是_______;从固体中分离出铜需采用的方法是_________。
⑶过程II中发生主要反应的化学方程式为:_____,。