A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比
是 .
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与
足量的Ba(OH)2溶液反应的离子方程式 .
(3)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g)
2CA3(g)
ΔH=-92.4 kJ·mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,总容积为1.0 L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol,A2 0.5mol,CA3 0mol B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.5mol/L,A2 0.3mol/L,CA3 0.2mol/L
②若起始加入1.2molC2、1.0molA2,达平衡后C2的浓度为__________mol/L
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将________(填“正向”、“逆向”或“不”)移动.
化合物Ⅰ(
)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。Ⅰ可以用
和
在一定条件下合成:
已知以下信息:
的核磁共振氢谱表明其只有一种化学环境的氢;
 化合物
苯环上的一氯代物只有两种;
化合物
苯环上的一氯代物只有两种;
通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)
的化学名称为。
(2)
的结构简式为。
(3)
的分子式为。
(4)
生成
的化学方程式为,该反应类型为。
(5)
的结构简式为。
(6)
的同系物
比
相对分子质量小14,
的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和
溶液反应放出
,共有种(不考虑立体异构)。
的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出
的这种同分异构体的结构简式。
前四周期原子序数依次增大的元素
,
,
,
中,
和
的价电子层中未成对电子均只有1个,平且
和
的电子相差为8;与
位于同一周期的
和
,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)
的价层电子排布图为。
(2)四种元素中第一电离最小的是,电负性最大的是。(填元素符号)
(3)
、
和
三种元素责成的一个化合物的晶胞如图所示。
①该化合物的化学式为;
的配位数为;
②列式计算该晶体的密度
。
(4)
、
和
三种离子组成的化合物
,其中化学键的类型有;该化合物中存在一个复杂离子,该离子的化学式为,配位体是。
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(
)所示。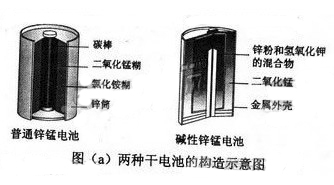
回答下列问题:
(1)①普通锌锰电池放电时发生的主要反应为:
。该电池中,负极材料主要是,电解质的主要成分是,正极发生的主要反应是。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。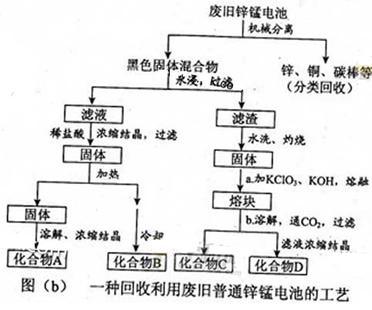
①图(
)中产物的化学式分别为
,
。
②操作
中得到熔块的主要成分是
。操作
中,绿色的
溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为。
③采用惰性电极电解
溶液也能得到化合物
,则阴极处得到的主要物质是。(填化学式)
査尔酮类化合物G是黄酮类药物的主要合成中间体,其中一种合成路线如下: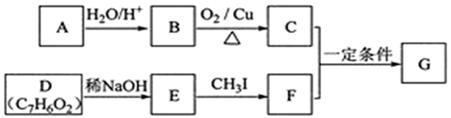
已知以下信息:
① 芳香烃A的相对分子质量在100 ~110之间,1
充分燃烧可生成72
水。
② C不能发生银镜反应。
③ D能发生银镜反应、可溶于饱和
溶液、核磁共振氢谱显示有4种氢。
④ 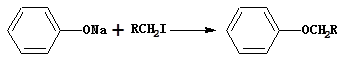
⑤
回答下列问题:
(1)
的化学名称为。
(2)由
生成
的化学方程式为。
(3)
的分子式为,由
生成
的反应类型为。
(4)
的结构简式为。
(5)
的芳香同分异构体
既能发生银镜反应,又能发生水解反应,
在酸催化下发生水解反应的化学方程式为。
(6)
的同分异构体中,既能发生银镜反应,又能与
溶液发生显色反应的共有种,其中核磁共振氢谱为5组峰,且峰面积比为2∶2∶2∶1∶1的为(写结构简式)。
硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态
原子中,电子占据的最高能层符号为,该能层具有的原子轨道数为、电子数为。
(2)硅主要以硅酸盐、等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以相结合,其晶胞中共有8个原子,其中在面心位置贡献个原子。
(4)单质硅可通过甲硅烷(
)分解反应来制备。工业上采用
和
在液氨介质中反应制得
,该反应的化学方程式为。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 |
||||||
| 键能/( | 356 |
413 |
336 |
226 |
318 |
452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是。
②
的稳定性小于
,更易生成氧化物,原因是
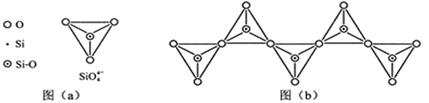
(6)在硅酸盐中
4四面体(如下图(
))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(
)为一种无限长单链结构的多硅酸根,其中
原子的杂化形式为
与
的原子数之比为化学式为。