下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L硫酸溶液,其他试剂任选。填写下列空白:
(1)B中盛有一定量的NaOH溶液,D仪器的名称 ,此实验D仪器中需要
放入 溶液,A中应预先加入的试剂是 ,A中反应的离子方程式
为 。
(2)实验开始时应先将活塞E (填“打开”或“关闭”), 在C中收到的气体主要为 ;当C瓶或A瓶中的气泡 时,将活塞E (填“打开”
或“关闭”),此刻B瓶中可能发生的化学反应(用离子方程式表示)是:
_ ;
(3)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:
。
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10 mL 2% H2O2溶液 |
无 |
| ② |
10 mL 5% H2O2溶液 |
无 |
| ③ |
10 mL 5% H2O2溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ |
10 mL 5% H2O2溶液+少量HCl溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ |
10 mL 5% H2O2溶液+少量NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_______________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为_____________________。
(3)实验①和②的目的是______________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_______________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。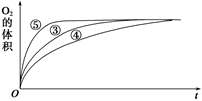
分析上图能够得出的实验结论是__________________________。
现有下列化学仪器与用品:①玻璃棒 ②烧杯 ③托盘天平 ④量筒 ⑤药匙 ⑥胶头滴管 ⑦容量瓶 ⑧标签纸 ⑨细口试剂瓶
Ⅰ.称量:若需要配制500 mL 0.622 moL / L NaOH溶液,则应称取固体NaOH g;
Ⅱ.用以上称量后的NaOH固体配制溶液并备用:按配制溶液的过程顺序,从上述所给仪器和用品中选取需要的仪器(重复的不计),其编号排列是 ;
Ⅲ.配制过程中,应将固体NaOH溶解后并冷却至室温的溶液转移到 中,在转移时玻璃棒起 作用;在液面接近容量瓶刻度线 处,改用 定容。
Ⅳ.若实验中遇到下列情况,可能导致溶液浓度偏高的是 (填字母):
| A.固体氢氧化钠溶解时未冷却至室温,就开始转移、洗涤以及定容; |
| B.转移时不小心有少量溶液流到了容量瓶外; |
| C.定容时仰视容量瓶刻度线; |
| D.定容时加水超过了刻度线,马上用胶头滴管吸去多余的水。 |
E、配制好后,发现称量时所用的托盘天平的砝码生锈了
硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
(1)实验Ⅰ中,铝片作________(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是________。
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是________。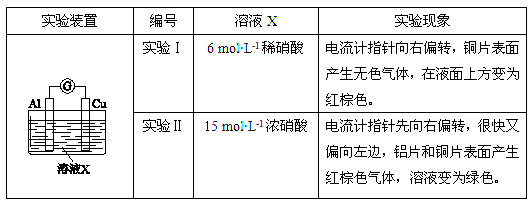
查阅资料:活泼金属与1 mol·L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原。
(3)用上图装置进行实验Ⅲ:溶液X为1 mol·L-1稀硝酸溶液,观察到电流计指针向右偏转。
① 反应后的溶液中含NH4+。实验室检验NH4+的方法是________。
② 生成NH4+的电极反应式是________。
(4)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ: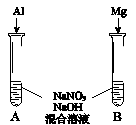
① 观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的解释是________。
②A中生成NH3的离子方程式是________。
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由____________。
异丙苯( )氧化法是工业生产苯酚和丙酮最主要的方法。其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法。其反应和流程如下:
已知:
完成下列填空:
(1).X物质是 ;Y物质是 。
(2).浓硫酸的作用是 ,其优点是用量少,可能的缺点是 (写一条)。
(3).Z物质最适宜选择 (选填编号)。
a.NaOH b.Na2CO3 c.NaHCO3 d.CaCO3
(4).步骤⑥分馏,工业上在分馏塔中进行,如右图,产品T是 ,请说明理由 。
废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定:
①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:
c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶。
②充分反应后,稍松开瓶塞,从瓶塞和瓶壁间缝隙迅速加入10%KI溶液10mL(过量),迅速加盖,充分摇匀。加入少许淀粉溶液。
③用0.0250 mol/LNa2S2O3标准溶液滴定至终点。用去Na2S2O3溶液22.48mL。
(5).已知:BrO3–+5Br–+6H+→3Br2 + 3H2O ;写出苯酚与浓溴水反应的化学方程式 ;
第①步加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是 。
(6).已知:I2 + 2Na2S2O3→2NaI + Na2S4O6;滴定终点的现象是 ;该废水中苯酚的浓度是 mol/L(保留4位小数)。
实验小组为探究SO2的漂白性和还原性,设计了以下实验。
完成下列填空:
(1).实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,有下列三种硫酸溶液,应选用 (选填编号),其理由是 。
a.98%浓硫酸 b.70%硫酸 c.10%稀硫酸
І.漂白性
(2).用如图所示装置(气密性良好)进行实验,观察到如下现象:ⅰ中红色褪去、
ⅱ中无变化。
①足量碱石灰的作用是 。
②从实验中可知使品红的水溶液褪色的 微粒可能是 。
(3).实验小组进一步实验如下:取等量相同浓度
的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,于是得出结论:使品红褪色的微粒肯定是HSO3–或SO32–。你认为这一结论是否正确 ,理由是 。
ІІ.还原性
(4).将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是 ,如何检验该反应所得含氧酸根离子 。
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32–。
则②中红棕色变为浅绿色的原因是 。