某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10 mL 2% H2O2溶液 |
无 |
| ② |
10 mL 5% H2O2溶液 |
无 |
| ③ |
10 mL 5% H2O2溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ |
10 mL 5% H2O2溶液+少量HCl溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ |
10 mL 5% H2O2溶液+少量NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_______________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为_____________________。
(3)实验①和②的目的是______________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_______________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。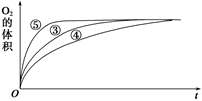
分析上图能够得出的实验结论是__________________________。
实验室制取乙酸乙酯的主要步 骤如下:
骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按右图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。④分离出乙酸乙酯层、洗涤、干燥。
(1)配制该混合溶液的主要操作步骤为:__ _____________________________________;反应中浓硫酸的作
_____________________________________;反应中浓硫酸的作 用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
A.中和乙酸和乙醇。
B.中和乙酸并吸收部分乙醇。
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。
(3)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有__________;分离时,乙酸乙酯应该从仪器 ________(填:“下口放” 或“上口倒 ”)出。
”)出。
(11分)某同学用下图所示装置制取乙烯,请回答: 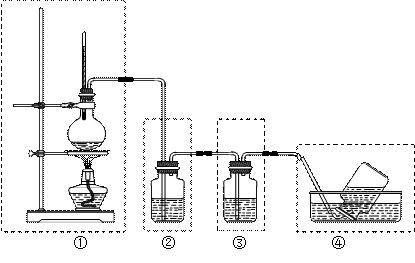
(1)在装置①~③中,有明显错误的一个装置是_____(填序号),改进方法是
。
(2)实验室制取乙烯的化学方程式为,反应类型为。
(3)配制乙醇和浓硫酸混合液的方法是。
(4)若装置②中所盛试剂为氢氧化钠溶液,则其作为。
(5)若装置③中的试剂为溴的四氯化碳溶液,观察到的现象是。
(6)实验前往往在烧瓶中加入一些碎瓷片,目的是_________________________。
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现取两份100 mL溶液进行如下实验:
①第一份加过量NaOH溶液加热后,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。 ②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。
根据上述实验回答:
(1)一定不存在的离子是__________________,不能确定是否存在的离子是__________。
(2)试确定溶液中肯定存在的离子及其浓度(可不填满):
离子符号________,浓度______________________________________________;
离子符号________,浓度______________________________________________;
离子符号________,浓度______________________________________________。
(3)试确定K+是否存在________(填“是”或“否”),判断的理由是_______________。
(12分)在烧杯里加入20 mL 0.1 mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液。实验装置如下图(夹持仪器已去掉):
实验现象如下:
①灯泡逐渐变暗;
②烧杯中有白色沉淀生成,溶液红色变浅甚至消失。
请依据实验现象回答下列问题:
(1)灯泡变暗的原因是__________________________________________________。
(2)有白色沉淀生成,说明______________________________________________,
红色变浅说明________________________________________________________。
(3)当Ba2+恰好完全沉 淀时,消耗NaHSO4溶液的体积为______ mL,溶液呈______色,离子反应方程式为_________
淀时,消耗NaHSO4溶液的体积为______ mL,溶液呈______色,离子反应方程式为_________ ___________________________________________________。
___________________________________________________。
(4)若向(3)得到的 溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为___________________________________________________________________。
溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为___________________________________________________________________。
某学生往一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):
| A.KI溶液 | B.淀粉溶液 | C.NaOH溶液 | D.稀H2SO4E.氯水 |
发现溶液颜色按如下顺序变化:①无色―→②棕黄色―→③蓝色―→④无色―→⑤蓝 色。依据溶液颜色的变化,回答下列问题:
色。依据溶液颜色的变化,回答下列问题:
(1)加入以上药品的顺序是(写序号)_______________________________________。
(2)①―→②反应的化学方程式为_________________________________________。
(3)溶液由棕黄色变为蓝色的原因是_______________________________________。
(4)③―→④反应的化学方程式为__________________________________________。