今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现取两份100 mL溶液进行如下实验:
①第一份加过量NaOH溶液加热后,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。 ②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。
根据上述实验回答:
(1)一定不存在的离子是__________________,不能确定是否存在的离子是__________。
(2)试确定溶液中肯定存在的离子及其浓度(可不填满):
离子符号________,浓度______________________________________________;
离子符号________,浓度______________________________________________;
离子符号________,浓度______________________________________________。
(3)试确定K+是否存在________(填“是”或“否”),判断的理由是_______________。
下图是实验室制取气体的装置图(固定装置省略),请回答下列问题:
(1)仪器名称:a ,b 。
(2)B图的装置可用来制取一种具有助燃性的气体,写出制取该气体的化学方程式: ,该装置操作上的优点是 。
D装置操作上的优点是 。
(3)写出实验室用高锰酸钾制取氧气的化学方程式 ,若用E收集一瓶干燥的氧气,其中Ⅰ瓶中盛放的试剂是 (填名称),并将图E补充完整。
(4)实验室用锌粒与稀硫酸反应制取氢气,发生装置如图所示。打开止水夹,若发现稀硫酸未能与有孔塑料板上锌粒接触,但此时已无稀硫酸可加,则下列溶液中,最适宜从长颈漏斗中添加的是_________(填字母)。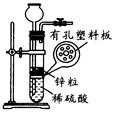
| A.氢氧化钠溶液 | B.碳酸钠溶液 |
| C.硫酸钠溶液 | D.澄清石灰水 |
某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50 g 5%的氯化钠溶液。
实验一:如图是同学们做粗盐提纯实验的操作示意图。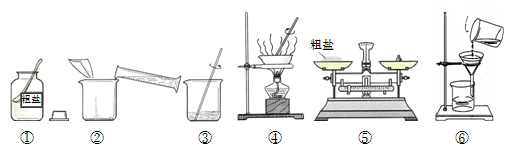
请回答下列问题:
(1)操作③中用玻璃棒搅拌的作用是 。
(2)操作⑥中的错误是 。
(3)粗盐提纯实验的操作顺序为(填操作序号) 、称量精盐并计算产率。
(4)操作④中,当观察到 时,停止加热。
实验二:用提纯得到的精盐配制了50g 5%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有 (填序号)。
①氯化钠固体仍然不纯
②量取水时,俯视读数
③称量时砝码端忘垫质量相同的纸片
④装瓶时,有少量溶液洒出
【2015海南化学】[选修2—化学与技术]
Ⅰ下列有关海水综合利用的说法正确的是 。
| A.电解饱和食盐水可制得金属钠 | B.海带提碘只涉及物理变化 |
| C.海水提溴涉及到氧化还原反应 | D.海水提镁涉及到复分解反应 |
Ⅱ
铁在自然界分别广泛,在工业、农业和国防科技中有重要应用。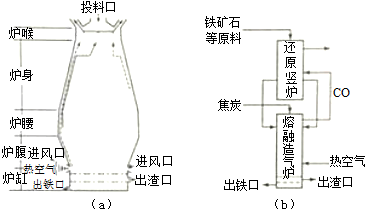
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有 。除去铁矿石中脉石(主要成分为SiO2)的化学反应方程式为 、 ;高炉排出气体的主要成分有N2、CO2和 (填化学式)。
(2)已知:①Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+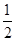 O2(g)=CO2(g)ΔH=-283kJ·mol-1
O2(g)=CO2(g)ΔH=-283kJ·mol-1
③C(s)+ 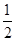 O2(g)=CO(g)ΔH=-110kJ·mol-1
O2(g)=CO(g)ΔH=-110kJ·mol-1
则反应Fe2O3 (s)+3 C(s)+ 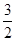 O2(g)=2Fe(s)+3CO2 (g)的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
O2(g)=2Fe(s)+3CO2 (g)的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的 部分,主要反应的化学方程式为 ;熔融造气炉相当于高炉的 部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2污染空气,脱SO2的方法是 。
【2015山东理综化学】(12分)[化学---化学与技术]工业上利用氨氧化获得的高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3,工艺流程如下: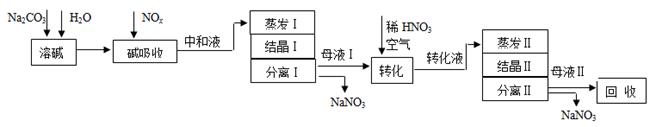
已知:Na2CO3+NO+NO2=2NaNO2+CO2
(1)中和液所含溶质除NaNO2及少量Na2CO3外,还有__________(填化学式)。
(2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是_______。蒸发Ⅰ产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的_______(填操作名称)最合理。
(3)母液Ⅰ进行转化时加入稀HNO3的目的是_______。母液Ⅱ需回收利用,下列处理方法合理的是_______。
a.转入中和液 b.转入结晶Ⅰ操作
c.转入转化液d.转入结晶Ⅱ操作
(4)若将NaNO2、NaNO3两种产品的物质的量之比设为2:1,则生产1.38吨NaNO2时,Na2CO3的理论用量为______吨(假定Na2CO3恰好完全反应)。
【2015新课标Ⅱ卷理综化学】【化学——选修2:化学与技术】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:

相关化合物的物理常数
| 物质 |
相对分子质量 |
密度(g/cm-3) |
沸点/℃ |
| 异丙苯 |
120 |
0.8640 |
153 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 苯酚 |
94 |
1.0722 |
182 |
回答下列问题:
(1)在反应器A中通入的X是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜C中加入的Y为少置浓硫酸,其作用是______,优点是用量少,缺点是_______________。
(4)反应②为 (填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是 。
(5)中和釜D中加入的Z最适宜的是 (填编号。已知苯酚是一种弱酸)。
a.NaOH b.CaCOc.NaHCO d.CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。