(6分)右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
Ⅰ.硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的括号内:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
(1)浓硫酸可以干燥氢气( )
(2)浓硫酸使木条变黑 ( )
(3)热的浓硫酸与铜片反应( )
Ⅱ.现用该浓硫酸配制100 mL 1 mol/L的稀硫酸。可供选用的仪器有: ①胶头滴管; ②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平;⑦玻璃棒; ⑧100mL容量瓶。请回答:
(1)配制稀硫酸时,上述仪器中不需要使用的有 (选填序号)。
(2)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL。
(3)下列操作会使配制的溶液浓度偏高的是( )
| A.量取浓H2SO4时,俯视刻度线 | B.定容时,俯视容量瓶刻度线 |
| C.配制前,容量瓶中有水珠 | D.定容后摇匀发现液面下降而未向其中再加水 |
(14分)半导体生产中常需要控制掺杂,以保证控制电阻率。三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生成 H3PO3和HC1。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为。
(2)B中所装试剂是,
E中冷水的作用是,
F中碱石灰的作用是____。_
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00 g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00 mL,向其中加入10.00 mL 0.1000 mol·L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol·L-1的Na2S2O3,溶液滴定②重复②、③操作,平均消耗Na2S2O3,溶液8.40 mL
已知:H3PO3+H2O+I2 =H3PO4+2HI,I2+2Na2S2O3 = 2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程为:
已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
| 沉淀完全的pH |
3.7 |
9.7 |
Ⅱ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
(1)操作①需要加快反应速率,措施有充分搅拌和(写一种)。
碳酸锶与盐酸反应的离子方程式。
(2)在步骤②-③的过程中,将溶液的pH值由1调节至;宜用的试剂为。
A.1.5
B.3.7
C.9.7
D.氨水
E.氢氧化锶粉末
F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是(填化学式)。
(4)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃B.80~100℃C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是。
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体,下列装置可用于CO2气体的提纯和干燥。
完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6mol·L-1),需要的玻璃仪器有。
(2)上述装置中,A是溶液,其作用是。
(3)上述装置中,B物质是。
(4)一次性饭盒中石蜡和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重 → 浸泡溶解 → 过滤 → 残渣烘干 → 冷却、称重 → 恒重
①从物质分类的角度分析,石蜡属于有机物中的类,为了将石蜡从饭盒中溶出,应选用下列试剂中的。
a.氯化钠溶液b.稀醋酸c.稀硫酸 d.正已烷
②饭盒中的碳酸钙常用稀醋酸将其溶出,试写出其反应的离子方程式:。
以黄铜矿为主要原料来生产铜、铁红颜料和硫单质,原料的综合利用率较高。其主要流程如下: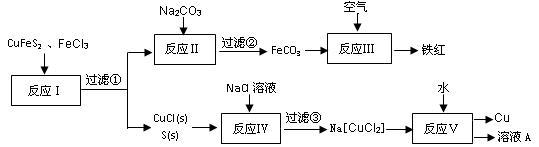
回答下面问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是要消耗大量的热能以及(完成合理的一种即可)。
(2)过滤③得到的滤渣成分是(填化学式)。
(3)反应Ⅰ~Ⅴ中,共有个反应不属于氧化还原反应。
(4)溶液A中含有的溶质是(填化学式)。
(5)写出反应Ⅰ的化学方程式。
(6)①反应Ⅲ是FeCO3在空气中煅烧,写出化学方程式。
②反应Ⅳ中发生反应的离子方程式。
过氧化钙在常温下是无色或淡黄色粉末,易溶于酸,难溶于水、乙醇等溶剂,常用于种子消毒、药物制造、鱼池增氧等。
I.某实验小组在实验室用钙盐制取CaO2·8H2O(该反应为放热反应)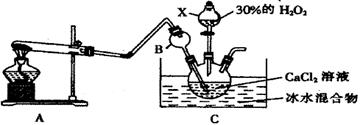
(1)A为实验室制取氨气的装置,则A中试管所装的试剂的名称为。
(2)仪器B的作用是。
(3)写出生成CaO2·8H2O的离子方程式。
(4)制取CaO2·8H2O一般在0~5℃的低温下进行,原因是。
II.该实验小组欲通过测量气体的体积来探究CaO2与SO2反应的特点。装置如下图:
(硬质玻璃管中为无水CaO2)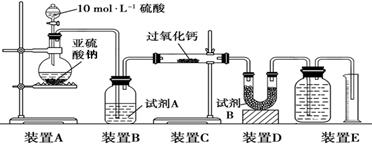
【提出假设】
假设1:反应只发生2SO2+2CaO2=2CaSO3+O2,SO2未被氧化;
假设2:反应只发生SO2+CaO2=CaSO4,SO2完全被氧化;
假设3:上述两个反应均发生,SO2部分被氧化。
【实验探究】
(5)该实验装置有一处明显错误,请改正。
(6)试剂A为浓硫酸,试剂B的作用是。
【实验数据处理】实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,
装置E中收集到的气体为V L(已换算成标准状况下)。
(7)在记录量筒中的液面位置时,除视线平视外,还应。
(8)如果假设3成立,则V的取值范围是【M(CaO2)=72,M(CaSO3)=120】。