过氧化钙在常温下是无色或淡黄色粉末,易溶于酸,难溶于水、乙醇等溶剂,常用于种子消毒、药物制造、鱼池增氧等。
I.某实验小组在实验室用钙盐制取CaO2·8H2O(该反应为放热反应)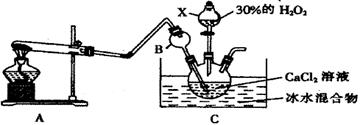
(1)A为实验室制取氨气的装置,则A中试管所装的试剂的名称为 。
(2)仪器B的作用是 。
(3)写出生成CaO2·8H2O的离子方程式 。
(4)制取CaO2·8H2O一般在0~5℃的低温下进行,原因是 。
II.该实验小组欲通过测量气体的体积来探究CaO2与SO2反应的特点。装置如下图:
(硬质玻璃管中为无水CaO2)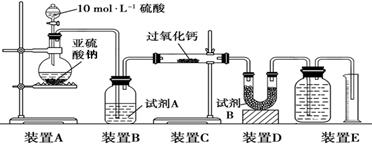
【提出假设】
假设1:反应只发生2SO2+2CaO2=2CaSO3+O2,SO2未被氧化;
假设2:反应只发生SO2+CaO2=CaSO4,SO2完全被氧化;
假设3:上述两个反应均发生,SO2部分被氧化。
【实验探究】
(5)该实验装置有一处明显错误,请改正 。
(6)试剂A为浓硫酸,试剂B的作用是 。
【实验数据处理】实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,
装置E中收集到的气体为V L(已换算成标准状况下)。
(7)在记录量筒中的液面位置时,除视线平视外,还应 。
(8)如果假设3成立,则V的取值范围是 【M(CaO2)=72,M(CaSO3)=120】。
(11 分)钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。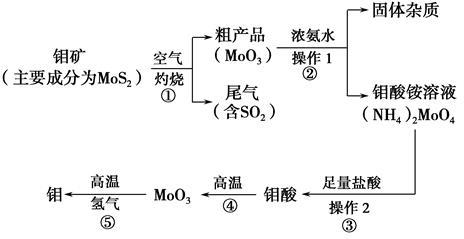
(1)反应①的尾气可以用NH3•H2O溶液吸收合成肥料,写出反应的离子方程式 .
(2)钼酸铵溶液中的主要阳离子的检验方法: .
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有 。
(4)写出反应①的化学方程式: 。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2,
2CO+2H2,
CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
(10分)高纯度氧化铝有广泛的用途,某研究小组用以下流程制取高纯度氧化铝:
根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+.请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式
(2)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是
(3)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水).母液不能蒸干的原因是
(4)“分离”操作的名称是 (填字母代号).
A.蒸馏 B.分液 C.过滤
(5)铵明矾晶体的化学式为NH4Al(SO4)2•12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是 ,离子浓度最小的离子是 .
(14分)某校化学实验兴趣小组在“探究卤索单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入l~2滴溴水,振荡后溶液呈黄色。
提出问题 Fe3+、Br2谁的氧化性更强?
(1)猜 想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含 (填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含 所致。
(2)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液;b.CCl4;c.无水酒精;d.KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 |
实验现象 |
|
| 方案1 |
||
| 方案2 |
(3)结论:氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入l~2滴溴水,溶液呈黄色所发生的离子反应方程式为 。
(4)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是: (填离子的化学式)。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
(12分) 为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)
所示装置来测定。乙同学拟采用图(2)所示装置来测定。
请回答下列问题:
(1)甲同学用图(1)装置来测定,在没有放样品前,检查该装置气密性的方法之一是从酸式滴定管向烧瓶中加入一定量的水,观察到 现象,证明此装量不漏气。实验时称得样品的质量为mg,酸式滴定管的起始读数为amL,终了读数为bmL,注射器测定排出的气体为c mL(已折算成标准状况),该样品中Na2C03的质量分数为(用含a、b、c、m的代数式表示)____ 。
(2)本实验选用稀H2S04而未选用稀盐酸的原因是 。
(3)乙同学观察了甲同学的实验后很受启发,并发现自己的图(2)原实验设计方案会造成误差.其原因之一可能是C02在水中溶解度较大,引起测量气体体积减小。
丙同学经思考后。建议乙同学将图(2)中某部分稍作改进,就可避免此种误差,写出你的改进方案 。
(4)丁同学提出将图(2)装置中量气装置去掉,只用反应装置和天平也能较准确地测出样品中Na2C03的质量分数,请你分析丁同学方案中,除了测定样品的质量,还需测定的另两个数据是 、 。
(5)还可以用其他实验方法测定试样中纯碱的质量分数,请简述一种与上述各方法不同的实验方法 。
七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4•7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 .
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 .