(11 分)钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
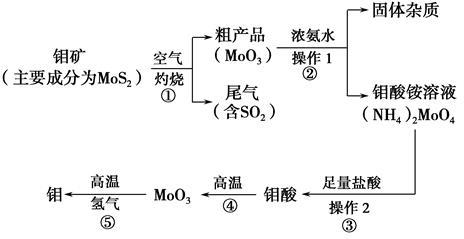
(1)反应①的尾气可以用NH3•H2O溶液吸收合成肥料,写出反应的离子方程式 .
(2)钼酸铵溶液中的主要阳离子的检验方法: .
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有 。
(4)写出反应①的化学方程式: 。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2,
2CO+2H2,
CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2)。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。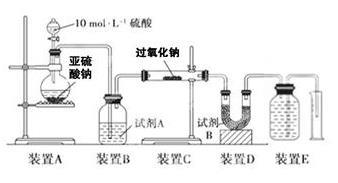
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:
假设1:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;
假设3: ,证明 。
实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:
(2)试剂A可以选用____________________,试剂B的作用是________________________。
(3)实验测得装置C中过氧化钠质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据判断SO2未被氧化、完全被氧化的V-m1关系式。
未被氧化:____________________,完全被氧化:_______________________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。
2013年6月,我国“蛟龙”号再次刷新“中国深度”——下潜7062米,为我国深海矿物资源的开发奠定了基础。海洋深处有丰富的锰结核矿,锰结核的主要成分是MnO2,同时还含有黄铜矿。
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用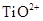 发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。
发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。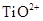 发生水解的离子方程式为_______________________。
发生水解的离子方程式为_______________________。
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如下图所示: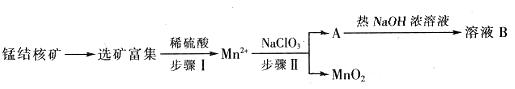
(1)步骤Ⅱ中以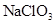 为氧化剂,当生成0.05mol
为氧化剂,当生成0.05mol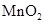 时,消耗
时,消耗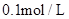 的
的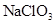 溶液200ml,该反应离子方程式为______________________。
溶液200ml,该反应离子方程式为______________________。
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是_________________。
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;
(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3。
根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是_____________________。
(2)设计实验证明炉渣中含有FeO________________________________。
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
| 实验 |
① |
② |
③ |
④ |
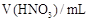 |
50 |
100 |
150 |
200 |
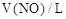 |
1.344 |
2.688 |
3.36 |
3.36 |
则:①m=____________g ②写出实验②发生反应后溶液中Fe2+与Fe3+物质的量之比为:____________。
某次实验需用480mL、0.5mol/L的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)如果实验室有10mL、15mL、50mL量筒,最好应选用 mL的量筒来量取所需的98%的浓硫酸的体积 mL。
(2)将下列步骤中的空格内将所用仪器补充填写完整
①用20mL量筒量取所需的浓硫酸
②将烧杯中的溶液转移到仪器A中(仪器A的名称为 )
③将浓硫酸缓缓注入盛有适量仪蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复室温
⑤向仪器A中加入蒸馏水,在距离刻度1-2cm时,改用 加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2-3次,洗涤液也注入仪器A中,轻轻摇动仪器A,使溶液混合均匀。
(3)实验中上述步骤的正确顺序为 (填写序号)
(4)下列操作会引起所配溶液浓度偏大的是 (填写字母)
A.量筒用蒸馏水洗涤后未干燥即用来冷却浓硫酸
B.容量瓶用蒸馏水洗净后未干燥即用来配制溶液
C.定容时,观察液面俯视刻度线
E.取用浓硫酸后,将量筒用蒸馏水洗涤并将洗涤液转移容量瓶中
F.摇匀后,液面低于刻度线,没有再加蒸馏水
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下来实验常用到的仪器回答问题:
(1)填写以下仪器的名称:B D E G 。
(2)用四氯化碳提取出溴水中Br2单质的方法叫做: ,将Br2的四氯化碳溶液和水分离开的操作叫做: ,下列是进行该操作的步骤,正确的是顺序是: 。
①将混合物倒入分液漏斗中,并放在铁架台的铁圈上静置,分层;
②从分液漏斗上口倒出上层溶液
③将分液漏斗的玻璃塞打开或使玻璃塞上的凹槽对准漏斗颈部的小孔
④分液漏斗下面导管紧贴烧杯内壁,旋开活塞,用烧杯接受溶液
⑤检查分液漏斗活塞和颈部的玻璃塞是否漏水
(3)已知Br2的沸点是58.5°C,四氯化碳沸点是78°C。将Br2的四氯化碳溶液分离开的方法是 。需要用到的玻璃仪器有(填字母) 。
(原创)重庆一中某化学兴趣小组,欲在常温常压下,用一定质量的铜镁合金与足量稀盐酸反应,利用下图装置,测定样品中铜的质量分数。
A B C
(1)实验反应原理:写出镁与稀盐酸发生反应的化学方程式________________
(2)仪器识别:写出上图中仪器①、②的名称:①_________②__________
(3)装置连接:a→___________→___________→d
(4)A中反应已经进行完毕的现象为__________________________
(5)实验中,该兴趣小组同学测得以下数据
a.反应前样品铜镁合金的质量,记为m1 g
b.反应结束后,经过处理后的残余固体的质量,记为m2 g
c.经过一系列正确的操作后,读取量筒中的水的体积,记为V mL
d.查阅资料,常温常压下,H2的密度为ρ g/L
四位同学分成甲、乙两个小组,甲组同学利用重量法为思路,请合理选择以上数据,列式求铜的质量分数:________×100%;乙组同学利用排水法测量气体体积为思路,请合理选择以上数据,列式求铜的质量分数:________×100%
(6)误差分析环节中指导教师提出,甲、乙两组同学的思路中,会有很多因素导致测得的铜的质量分数出现误差,现将可能导致误差的因素罗列如下,并回答相关问题
a.读取量筒中水的体积时,未等装置中气体恢复至室温
b.读取量筒中水的体积时,俯视量筒
c.实验开始前,没有检查装置气密性,然而装置实际是漏气的
d.B瓶中残留的空气的干扰
e.未除去样品铜镁合金表面的氧化膜便进行称量
f.未对反应中挥发出的HCl气体进行除杂处理
g.未对反应后剩余的残余物进行洗涤
h.未考虑B、C装置间连接导管中残留的水
导致铜的质量分数大于理论值的原因可能是___________________(填符号a~h)
导致铜的质量分数小于理论值的原因可能是___________________(填符号a~h)