下列关于0.2 mol·L-1的Ba(NO3)2溶液的说法中,正确的是
| A.500 mL该溶液中Ba2+的浓度为0.1 mol·L-1 |
| B.500 mL该溶液中NO3-的浓度为0.2 mol·L-1 |
| C.500 mL该溶液中NO3-离子共0.2 mol |
| D.500 mL该溶液中Ba2+和NO3-离子共0.6 mol |
下列叙述正确的是( )
| A.直径介于1nm~10nm之间的微粒称为胶体 |
| B.电泳现象可证明胶体属于电解质溶液 |
| C.利用丁达尔效应可以区别溶液与胶体 |
| D.胶体粒子很小,可以透过半透膜 |
下列有关能量转换的说法正确的是 ( )
( )
| A.煤燃烧是化学能转化为热能的过程 |
| B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 |
| D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
下列说法中正确的 是( )
是( )
| A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子 |
B.金属 导电的原因是在外电场作用下金属产生自由电子,电子定向移动 导电的原因是在外电场作用下金属产生自由电子,电子定向移动 |
| C.分子晶体的熔沸点很低,常温下都呈液态或气态 |
| D.原子晶体中的各相邻原子都以共价键相结合 |
下列反应的离子方程式正确的是()
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体: |
| B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
C.实验室用浓盐酸与MnO2反应制Cl2: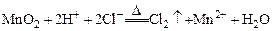 |
| D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
已知pH=1的某溶液中存在较多的Ba2+、NO3-,则该溶液中还可能大量存在的离子组是()
| A.Fe3+、F-、Cl- | B.Mg2+、SO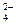 、Br- 、Br- |
| C.Mg2+、Cl-、Fe2+ | D.Na+、NH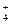 、Cu2+ 、Cu2+ |