(10分)某学生利用以下装置探究氯气与氨之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。 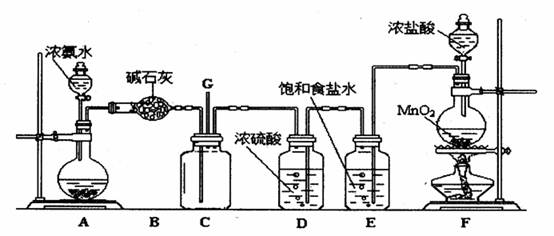
请回答下列问题:
(1)装置F中发生反应的化学方程式为 .
(2)装置B中仪器的名称是 ;装置E的作用是 .
(3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。
写出反应的化学方程式 .
(4)装置C内当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数
常数为 mol-1 (用含a、b的代数式表示)。
(5)将用F、E、D装置制得的氯气通人含74gCa(OH)2的石灰乳中,最多可制得漂白粉 g.
A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1、4、5、7,已知B的原子核外次外层电子数为2。A、C原子的次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中最强酸。则:
(1)A、B、C、D分别是_________、_________、_________、_________。
(2)A的离子结构示意图为:_________,C的原子结构示意图为_________。
(3)C的最高价氧化物对应的水化物与A的氢氧化物可生成_________种盐,其化学式分别为_________、_________、_________、_________(可不填满,也可补充)。
(4)C、D的气态氢化物稳定性由强到弱的顺序为_________。
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子多4。1.00 mol A的单质跟盐酸反应可置换出11.2 L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试完成下列问题:
(1)A是_________元素,B是_________元素,C是_________元素。
(2)分别写出A、B最高正价氧化物对应水化物分别跟C的气态氢化物水溶液反应的离子方程式:_____________________、_____________________。
(3)AN+的氧化性比Bm+的氧化性___________,这是由于_______________________。
(4)B的氢氧化物和氧化物都能与A的氢氧化物的水溶液反应,试分别写出其离子反应方程式:___________________________、___________________________。
根据元素周期表1~20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有___________种,金属性最强的元素与氧反应生成的化合物有___________ (填两种化合物的化学式)。
(2)属于稀有气体的是___________(填元素符号,下同)。
(3)形成化合物种类最多的两种元素是___________。
(4)第三周期中,原子半径最大的是___________(稀有气体除外)。
(5)推测Si、N最简单氢化物的稳定性___________强于___________(填化学式)。
、
、
和
是周期表中前20号元素,已知:
①
的阳离子和
的阴离子具有相同的核外电子排布,且能形成组成为
的化合物;
②
和
属同族元素,它们能形成两种常见化合物;
③
和
属同一周期元素,它们能形成两种气态化合物;
④
和
能形成组成为
的化合物;
⑤
和
不在同一周期,它们能形成组成为
的化合物。
请回答:
(1)
元素是;
元素是。
(2)化合物
和
的化学式分别是和。
(3)
和
形成的两种常见化合物的分子式是和。
(4)写出
和
形成的一种气态化合物跟
反应的化学方程式:。
AB2离子化合物的阴、阳离子的电子层结构相同,1molAB2分子中含有54mol电子,且有下列反应:
①H2+B2 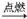 C
C
②B2+X→Y+AB2+H2O
③Y+C→AB2+Z,已知Z有漂白作用
(1)写出下列物质的化学式:
AB2,X,
Y,Z。
(2)写出反应②的化学方程式。
(3)写出反应③的离子方程式。