(12分)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。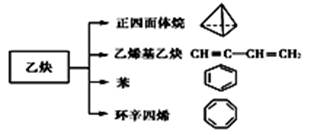
完成下列各题:
(1)正四面体烷的分子式为________,其二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法错误的是________。
a.能使酸性KMnO4溶液褪色
b.1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式_______________。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例)
_______________________、_____________________。
某校化学研究性学习小组学习了化学反应与能量的内容后,对CaCO3与稀盐酸的反应进行了相关探究。他们在室温条件下,将CaCO3块状固体放入1L、1mol•L-1稀盐酸中,记录下了随反应时间的变化生成CO2气体的物质的量情况,绘制成如图曲线。假设溶液的体积变化忽略不计,请分析以下问题:
(1)若想加快该反应的速率,可以采取的措施是、(答两种)。
(2)0~2min内,用HCl浓度变化表示的平均反应速率为,比较0~2min、2~4min、4~6min三个时间段,反应速率最大的是。
(3)根据定量的数据,定性的描述0~6min内该反应的化学反应速率的变化情况;呈现这种变化的原因是。
(4)根据图像中曲线的变化趋势,第8min时,该反应的反应速率为。
实验室利用如图装置进行中和热的测定。回答下列问题:
(1)该图中有两处实验用品未画出,它们是、 ;
(2)在操作正确的前提下提高中和热测定的准确性的关键是:。
(3)如果用0.5mol•L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将(填“偏大”、“偏小”、“不变”)原因是。
氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。
(1)如图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是。
(2)已知:①H2O(g)=H2O(l) ΔH=-Q1 kJ·mol-1
②C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-Q2 kJ/mol③C2H5OH(g)=C2H5OH(l) ΔH=-Q3 kJ/mol
则23 g液体酒精完全燃烧生成CO2(g)和H2O(l),释放出的热量为kJ(请用Q1、Q2、Q3来表示 )
已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
反应②CO(g)+1/2O2(g) CO2(g) ΔH=bkJ·mol-1;
CO2(g) ΔH=bkJ·mol-1;
反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为。(2)反应①为(选填“吸热”或“放热”)反应。(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有(填序号)。A.缩小反应器体积 B.通入CO2
C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图像符合反应①的是(填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
(5)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)的ΔH=。
2FeO(s)的ΔH=。
(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式:。
海底蕴藏着大量的“可燃冰”。用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油。
已知:
① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为。
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是 。
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac + CO + NH3 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性石墨棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
① 0<V≤44.8 L时,电池总反应方程式为。
② 44.8 L<V≤89.6 L时,负极电极反应为。
③ V="67.2" L时,溶液中离子浓度大小关系为。