(Ⅰ)化学平衡移动原理,同样也适用于其他平衡
(1)已知在氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O  NH+OH-
NH+OH-
向氨水中加入MgCl2固体时,平衡向 移动,OH-的浓度
向浓氨水中加入少量NaOH固体,平衡向 移动,此时发生的现象是___________。
(2)氯化铁水解的离子方程式为___________________,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为________________,同时有红褐色沉淀生成,其原因是
(3)向Mg(OH)2的悬浊液中加入NH4Cl溶液,现象 ,原
因为
(Ⅱ)某二元酸 H2A 的电离方程式是:H2A=H++HA,HA- A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)H2A是 (填“强电解质”或“弱电解质”或“非电解质”)
(2)Na2A 溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(3)NaHA 溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(4)若 0.1mol·L-1NaHA 溶液的 pH=2,则 0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能 0.11mol·L(填“<”、“>”或“=”),理由是: ;
(5)0.1mol·L NaHA溶液中各离子浓度由大到小的顺序是 。
【化学—物质结构与性质】
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。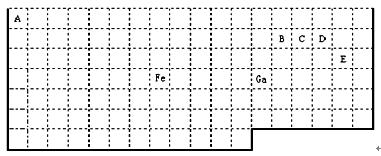
根据信息回答下列问题:
(1)周期表中比Ga质子数少2的基态原子价电子排布式为。
(2)Fe元素位于周期表的分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 ____和 _____(填化学式),CO的结构式为 。
(3)在CH4、CO及CH3OH中,碳原子采取sp3杂化的分子为 。
(4)根据VSEPR理论预测ED4- 离子的空间构型为______________型。B、C、D及E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的电子式为:__________________________________(写2种) 。
(5)B与D形成的稳定化合物为___________分子(填“极性”“非极性”),其固态为 ________晶体。
【化学—化学与技术】
聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:
(1)搅拌加热操作过程中发生反应的离子方程式为:;。
(2)生产过程中B和D的操作名称分别是和(B和D均为简单操作)。
(3)反应中副产品a是。
(4)生产过程中可循环使用的物质是(用化学式表示)。
(5)调节pH至4.0~4.5的目的是。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程C物质可选用。
| A.NaOH | B.Al | C.氨水 | D.Al2O3 |
下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。
请填写以下空白:
(1)A的化学式B的电子式。
(2)写出下列反应的化学方程式:
D+G→ H。
F+J → B + C + I。
(3)0.3mol I与足量C反应转移电子的物质的量为_________________mol。
(4)容积为10 mL的试管中充满I和G的混合气体,倒立于盛水的水槽中,水全部充满试管,则原混合气体中I与G的体积分别为_____mL,_____mL。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+ Na+ |
| 阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。

接通电源,经过一端时间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的_______极(填写“正”或“负”),甲、乙电解质分别为_______、_______(填写化学式)。
(2)计算电极f上生成的气体在标准状况下的体积:_____________。
(3)写出乙烧杯的电解池反应_____________________________。
(4)若电解后甲溶液 的体积为25L,则该溶液的pH为___________ 。
的体积为25L,则该溶液的pH为___________ 。
(5)要使丙恢复到原来的状态,应加入_______ g 。(填写化学式)
乙偶姻是一个极其重要的香料品种。乙偶姻(相对分子质量为88)中只含有C、H、O三种元素,其原子个数比为2:4:1 ,乙偶姻中含有碳氧双键。与乙偶姻有关的反应如下: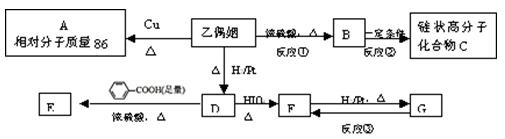
已知:
(1)乙偶姻的分子式为___________。
(2)X是乙偶姻的同分异构体,属于酯类,写出其所有可能结构简式________。
(3)写出反应①、③的反应类型:① ___________、③ ___________。
(4)A的一氯代物只有一种。写出下列物质的结构简式:
A ___________________、乙偶姻 __________________、C_________________。
(5)写出D → E反应的化学方程式_______________________________________。