制备溴苯的实验装置如右图所示,回答下列问题:
(1)该反应装置中仪器A的名称为 。反应开始前已向仪器A中加入的固体药品是铁粉,而装在左侧分液漏斗中的液体药品是 。
(2)冷凝管B有上、下两口,冷却水应从 口进入
(3)导管口不能插入锥形瓶中的液面之下,其原因 是 ;
(4)右侧分液漏斗中的物质在反应 时加入A中(填写反应前、反应中或者反应后)。用离子方程式表达其作用是 。
(5)反应结束向锥形瓶中的液体中加入硝酸酸化的硝酸银溶液,可见到现象是 。
(6)该过程可以如下表述:3Br2+2Fe=2FeBr3;Br2+FeBr3=FeBr4-+Br+(不稳定); +Br+→[
+Br+→[ ];[
];[ ]+FeBr4-→
]+FeBr4-→ +HBr+FeBr3;
+HBr+FeBr3;
由上反应可知: +Br2→
+Br2→ +HBr中的催化剂为( )
+HBr中的催化剂为( )
A Fe B FeBr3 C Br+ D FeBr4-
为研究盛装浓硫酸的铁质材料(碳素钢)与热浓硫酸的反应,某学习小组进行了以下探究活动:
[实验]
称取铁钉5.6g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除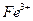 外还可能含有
外还可能含有 。若要确认其中的
。若要确认其中的 ,应选用
,应选用
(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性 溶液
溶液
②乙同学取448mL(标准状况)气体Y通入足量溴水中,
发生的反应式为:Br2+SO2+2H2O=2HBr+H2SO4
然后加入足量 溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中 的体积分数为。
的体积分数为。
[提出猜想]
分析上述实验中 体积分数的结果,同学们认为气体Y中还可能含量有其它气体并作如下猜想:
体积分数的结果,同学们认为气体Y中还可能含量有其它气体并作如下猜想:
猜想一:Y气体中可能含有H2;
猜想二:
猜想三:
[设计实验,验证猜想]
为验证以上猜想,同学们准备用下列装置设计探究实验(装置可重复使用,夹持仪器省略)。
①实验装置的连接顺序为A→____→_____→ F →____→______→F(填字母)。
②装置B中试剂的作用是。
③猜想一的理由是(用化学方程式表示)。
④)如果猜想一成立,预计实验现象应该是 ___。
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品4.1g,将样品配成250mL的待测液,需要的仪器有小烧杯、量筒、玻璃棒、、。(填仪器)
(2)取10.00mL待测液,用量取注入锥形瓶中。(填仪器)
(3)用0.2010mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手,右手,两眼注视,直到滴定终点。
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度:。
(5)根据上述测定数据,分析得到合理数据,计算烧碱的纯度。
( 14分)
(1)下列括号内的物质为杂质,将除去下列各组混合物中杂质所需的试剂填写在横线上:
苯(甲苯) ;苯(乙醇) ;甲苯(溴) 。
(2)实验室由电石中的碳化钙和水反应制取乙炔,该反应的化学方程式 为 ,实验中为了减缓反应速率,常用 代替水,若实验中产生的气体存在难闻的气味,可以用_________________(填试剂)加以除去。
为 ,实验中为了减缓反应速率,常用 代替水,若实验中产生的气体存在难闻的气味,可以用_________________(填试剂)加以除去。
(3)某兴趣小组的同学在实验室里制取的乙烯中常混有少量二氧 化硫,他们设计了下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
化硫,他们设计了下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
1)I、II、III、IV装置可盛放的试剂依次为 (填字母)
(填字母)
①品红溶液②NaOH溶液③浓硫酸④酸性KMnO4溶液
| A.④②①③ | B.①②①③ | C.①②①④ | D.④②①④ |
2)能说明SO2气体存在的现象是 。
3)使用装置III的目的是 。
4)确定含有乙烯的现象是 。
甲乙两人分别用不同的方法配制100ml 3.6mol/L的稀硫酸。
(1)甲:量取20 ml 18 mol/L浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 ml 容量瓶中,用少量的水将 烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
实验所用的玻璃仪器除烧杯、胶头滴管和容量瓶外,还有;
(2)乙:用100 ml 量筒量取20 ml 浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 ml 刻度线,再搅拌均匀。请指出乙同学的错误之处
①,
②。
用下列仪器的编号回答问题
①容量瓶②蒸馏烧瓶③分液漏斗④量筒⑤烧杯
⑴加热时必须垫石棉网的有,
⑵使用时必须检查是否漏水的有。