为了防止热带鱼池中水藻的生长,需保持水中Cu2+的浓度约1.2×10-5 mol·L-1。为避免在每次换池水时溶液浓度的改变,可把适当的含铜化合物放在池底,其饱和溶液提供适当的Cu2+。已知CuS、Cu(OH)2、CuCO3的Ksp值依次为1.3×10-36、2.2×10-20、1.4×10-10,下列四种物质中,能满足池水浓度要求的是
| A.CuSO4 | B.CuCO3 | C.Cu (OH)2 | D.CuS |
将4.6g金属钠投入到足量水中,得到ag溶液;将4.8g金属镁投入到足量盐酸中,得bg溶液。若水的质量与盐酸的质量相等,则反应后两溶液的质量关系式是()
| A.a=b | B.a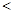 b b |
C.a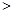 b b |
D.无法判断 |
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是()
| A.甲、乙中都是铝过量 | B.甲中铝过量、乙中碱过量 |
| C.甲中酸过量、乙中铝过量 | D.甲中酸过量、乙中碱过量 |
甲、乙两烧杯中各盛有100mL3mol/L的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束后测得生成的气体体积为甲:乙=1:2,则加入铝粉的质量为()
| A.5.4g | B.3.6g | C.2.7g | D.1.8g |
在烧杯中加入水和苯(密度:0.88g/cm3)各50mL。将一小粒金属钠(密度:0.97g/cm3)投入烧杯中,观察到的现象可能是()
| A.钠在水层中反应并四处游动 |
| B.钠停留在苯层中不发生反应 |
| C.钠在苯的液面上反应并四处游动 |
| D.钠在苯与水的界面处反应并可能做上、下跳动 |
将Mg、Al、Zn组成的混合物与足量盐酸作用,放出H2的体积为2.8L(标准状况下),则三种金属的物质的量之和可能为()
| A.0.25mol | B.0.125mol | C.0.100mol | D.0.080mol |