(15分)铁及其化合物在国民经济、日常生活中占有非常 重要的地位,了解铁及其化合物的性质和用途非常重要。请回答下列问题:
重要的地位,了解铁及其化合物的性质和用途非常重要。请回答下列问题:
(1)铁在自然界中以 态存在,其氧化物呈黑色的是 ,呈红褐色的是 (填写化学式)。
(2)铁在纯氧气中燃烧的化学方程式为 。
铁在氯气中反应的产物是 。
(3)要验证一种溶液中是否含有Fe3+、Fe2+,正确的实验方法是 。
A.向甲试管中 加入试液,滴入KSCN溶液,若显血红色,证明一定存在Fe3+。
加入试液,滴入KSCN溶液,若显血红色,证明一定存在Fe3+。
B.向乙试管中加入试液,滴入氯水,若氯水褪色,证明一定存在Fe2+。
C.向丙试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中一定存在Fe3+
(4)铁合金有下列数据:
| 钢 |
|||
| 碳素钢(Fe、C、Mn、Si) |
合金钢 |
||
| 低碳钢 |
中碳钢 |
高碳钢 |
碳素钢+Cr、Mn、W、Ni、Co等 |
| 含碳量<0.3% |
含碳量0.3%--0.6% |
含碳量>0.6% |
|
| 韧性好,强度低 |
韧性好、强度好 |
硬而脆 |
具有特殊性能 |
取15g某碳素钢样品,按下列实验流程进行操作:
①A、B的作用是 ,
②充分加热完全反应后,D装置质量增加0.022g,该样品属于 钢。
③没有A、B装置,实验结果 (填“偏高”“偏低”“不影响”)
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
用36.5%的盐酸配制20%的盐酸,操作步骤是(依次写出),配制过程中所需的定量仪器是。
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
写出铝、氧化铝分别与盐酸反应的离子方程式:
,,
A是该周期中(除稀有气体元素外)原子半径最大的元素,从原子结构上看其原因是________________________________________________。A、B、C三元素形成简单离子的半径大小顺序为____________。(用离子符号表示)
比较A、B单质活泼性的实验方法是__________________________________________。
已知A、B、C为同一短周期的三种元素,它们的原子序数依次增大且和为40;A是该周期中(除稀有气体元素外)原子半径最大的元 素,B元素的原子核外M层上的电子数比K层上的电子数多1。解答26-30小题:
素,B元素的原子核外M层上的电子数比K层上的电子数多1。解答26-30小题:
1.A原子的结构示意图为__________;A元素在周期表中位置为_____________________。
2.写出B的最高价氧化物与A的最高价氧化物对应水化物的溶液之间反应的离子方程式_______________________________________。
3.A和C形成的化合物的电子式为_____________,该化合物的水溶液呈__________性(填“酸”或“碱”)。
“物质结构与性质”
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为。在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为。在四大晶体类型中,GaN属于晶体。
(2)铜、铁元素能形成多种配合物。微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有的原子或离子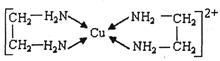
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:
① H、N、O三种元素的电负性由大到小的顺序是。
②SO2分子的空间构型为。与SnCl4互为等电子体的一种离子的化学式为。
③乙二胺分子中氮原子轨道的杂化类型为。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是。
④⑶中所形成的配离子中含有的化学键类型有。
a.配位键 b.极性键 c.离子键 d.非极性键
⑤CuCl的晶胞结构如右图所示,其中Cl原子的配位数为。