下列装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )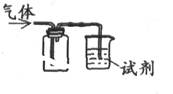
| 选项 |
试剂 |
现象 |
|
结论 |
| A |
酸性KMnO4溶液 |
溶液褪色 |
|
SO2有氧化性 |
| B |
品红溶液 |
溶液褪色 |
|
SO2有漂白性 |
| C |
NaOH溶液 |
无明显现象 |
|
SO2与NaOH溶液不反应 |
| D |
紫色石蕊试液 |
溶液变红后不褪色 |
|
SO2有酸性、没有漂白性 |
对于某一化学事实,下列表述错误的是()
| A.在加入铝粉能放出氢气的溶液中K+、NH4+、CO32—、C1—可能大量共存 |
| B.向Fe(OH)3胶体中逐滴滴入过量的稀硫酸,能发生“先沉淀后溶解”现象 |
| C.向饱和碳酸钠溶液中通入过量CO2的离子方程式为: 2Na++CO32—+CO2+H2O |
| D.0.1mol·L—1乙酸溶液的pH约为3,可证明它是弱电解质 |
下列说法错误的是()
| A.我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| B.含有磷元素的生活污水排人江河易引起水体富营养化,造成藻类过度繁殖影响水质导致环境污染 |
| C.“食用色素”、“碘元素”、“亚硝酸盐”在某些食品添加剂中允许含有,但符合限量是不会引起中毒的 |
| D.实行“汽车下乡”政策、大力推广使用家用小轿车不利于节能减排 |
在实验室中,下列除去杂质的方法正确的是
| A.溴苯中混有溴,加入KI溶液振荡,用汽油萃取出溴 |
| B.乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |
| C.硝基苯中混有浓HNO3和浓H2SO4,将其倒入NaOH溶液中振荡,静置,分液 |
| D.乙烯中混有SO2和CO2,将其通入酸性KMnO4溶液中洗气 |
下列有关苯与乙烯的比较中,正确的是
| A.分子中所有原子都在同一平面上 |
| B.都能被酸性高锰酸钾溶液氧化 |
| C.都能与溴水反应使溴水褪色 |
| D.等物质的量的苯和乙烯完全燃烧时,乙烯耗氧多 |
使1mol乙烯与氯气完全发生加成反应,然后使该加成反应的产物与氯气在光照条件下发生取代反应,则两个过程中消耗氯气的总物质的量最多为
| A.3 mol | B.4 mol | C.5 mol | D.6 mol |