(6分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)终点的判断:溶液由_____________________________________________________。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用
盐酸溶液的体积为_________ml。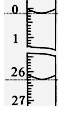
(4)某学生根据3次实验分别记录有关数据如表:
| 滴定 次数 |
待测NaOH溶液的体积/mL |
0.1000 mol/L盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
平均耗用盐酸 体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.15 |
①V=__________ |
| 第二次 |
25.00 |
0.56 |
30.30 |
|
| 第三次 |
25.00 |
0.20 |
26.45 |
②依据上表数据列式计算该NaOH溶液的物质的量浓度(计算结果取4位有效数)。
用质量分数为36.5 % 的浓盐酸(密度为1.2 g·cm-3)配制成250 mL 1.2 mol/L的稀盐酸。
(1)经过计算需要_______mL浓盐酸。
(2)在量取浓盐酸后,进行了如下操作:
①等稀释的盐酸冷却到室温后,将溶液沿玻璃棒小心地注入到250 mL的容量瓶中。
②往容量瓶中缓慢地加入蒸馏水至液面接近刻度线1 cm~2 cm处时,改用胶头滴管加蒸馏水,使溶液的凹液面正好与容量瓶的刻度线相切。
③在盛浓盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗液全部注入容量瓶中。
上述操作中,正确的顺序是______________(填编号)。
(3)配制完后,将容量瓶中的稀盐酸转移到指定的试剂瓶中存放,盖好塞子并贴上标签。
已知:A、B、C、D、E、F在常温下均为气体,它们有以下转化关系(部分反应条件、产物已略去)。
请回答下列问题:
(1)将A点燃后伸入到装有E的集气瓶中,可观察到的现象是_________________.
(2)C的浓溶液与黑色粉末反应生成E的化学方程式为________________________。
(3)若将溶液Ⅱ滴入到碘化钾溶液中,发生反应的离子方程式为__________________,向反应后的溶液中加入适量CCl4,充分振荡后静置,可以观察到的现象是_______________。 (4)与溶液Ⅰ比较,溶液Ⅱ中多出的物质是(填化学式)。
(4)与溶液Ⅰ比较,溶液Ⅱ中多出的物质是(填化学式)。
除去下列物质中的杂质,写出发生反应的离子方程式:
(1)硝酸钾中混有溴化钾___________
(2)碳酸氢钾溶液中混有碳酸钾___________,
(3)二氧化碳气体中混有氯化氢气体___________。
氯的原子结构示意图为,卤族元素随着核电荷数的增加,它们的活动性逐渐___________;简单离子的还原性逐渐__________。
由于钠很容易与空气中的、等物质反应,所以钠在自然界里只能以_________态存在。