纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-) =_____ mol/L;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-) =______ mol/L;在该温度时,往水中滴入NaOH溶液,溶液中的C(OH-)=5.0×10-2 mol/L,则溶液的PH值为 。 (已知lg5=0.7,lg3=0.477)
溶液中的化学反应大多是离子反应。根据要求回答下列问题。
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:
盐碱地产生碱性的原因:_______________;
(2)已知水存在如下平衡:H2O+H2O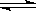 H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
(3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”、“<”或“=”)n。
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=______。
(5)在下图中画出用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 mol·L-1盐酸的滴定曲线示意图。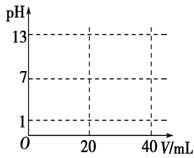
按要求填空
(一)现有如下各化合物:①酒精,②氯化铵,③氢氧化钡,④氨水,⑤蔗糖,⑥高氯酸,⑦氢硫酸,⑧硫酸氢钾,⑨磷酸,⑩硫酸。
请用以上物质的序号填写下列空白。
(1)属于电解质的有_______________。
(2)属于强电解质的有_____________。
(3)属于弱电解质的有_________ _ __。
(二)一定温度下有:a.盐酸 b.硫酸c.醋酸三种酸。
(1)当其物质的量浓度相同时,c(H+)由大到小的顺序是___________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH能力的顺序是_________.
(3)当c(H+)相同、体积相同时,同时加入锌,若产生相同体积的H2(相同状况),则开始时的反应速率_______,反应所需时间________。
(4)将c(H+)相同的三种酸均稀释10倍后,c(H+)由大到小的顺序是_______。
向2 L密闭容器中通入6 mol气体A和6 mol气体B,在一定条件下发生反应:xA(g)+yB(g) pC(g)+qD(g) 已知:平均反应速率v(C)=1/2v(A);反应2 min时,A的浓度减少了1mol/L,B的物质的量减少了3mol,有6mol D生成.回答下列问题:
pC(g)+qD(g) 已知:平均反应速率v(C)=1/2v(A);反应2 min时,A的浓度减少了1mol/L,B的物质的量减少了3mol,有6mol D生成.回答下列问题:
(1)反应2min内,v(A)=______,v(B)=______;
(2)该反应化学方程式中x:y:p:q=______;
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2,合并K1,若所盛溶液为CuSO4溶液:则A 极,A极的电极反应式为 .若所盛溶液为KCl溶液:则B极的电极反应式为 .
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是 ,Na+移向 极(填A、B);总反应化学方程式是 .
(3)如果要用电解的方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),反应一段时间后电解质溶液中Cu2+的浓度将会 (填“增大”、“减小”、“不变”)。
在如图中,甲烧杯中盛有100 mL 0.50 mol/L AgNO3 溶液,乙烧杯中盛有100 mL 0.25 mol/L CuCl2溶液,A、B、C、D均为 质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g。
(1)电源E为________极
(2)A极的电极反应式为______________,析出物质______ mol。
(3)B极的电极反应式为______________,析出气体______ mL(标准状况)。
(4)D极的电极反应式为______________,析出气体______ mL(标准状况)。
(5)甲烧杯中滴入石蕊试液,________极附近变红,如果继续电离,在甲烧杯中最终得到______溶液。