可降解聚合物G可由芳香烃A通过如下途径制备,质谱法测定A相对分子质量为102。
已知①B为高分子化合物,D的化学式为C8H10O2
②
③碳碳双键的碳上连有羟基的有机物不稳定

(1)对于高分子G的说法不正确的是( )
A.1mol G最多能与2n mol NaOH反应
B.一定条件下能发生取代与加成反应
C.碱性条件下充分降解,F为其中一种产物
D.(C9H8O3)n既是高分子G的化学式也是其链节的化学式
(2)A、X的化学式分别为________________ ,
(3)写出C→D的化学方程式 。
(4)写出B的结构简式
(5)同时符合下列条件F的稳定同分异构 体共 种,写出其中一种结构简式
①遇FeCl3不显紫色,除苯环外不含其它环状结构;
②苯环上有三种不同化学环境的氢原子;
③不能发生银镜反应。
(6)以苯和乙烯为原料可合成D,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下实例流程图:
CH3CHO  CH3COOH
CH3COOH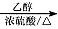 CH3COOCH2CH3
CH3COOCH2CH3
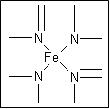
磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4溶液)制备磁材氧化铁的步骤如下: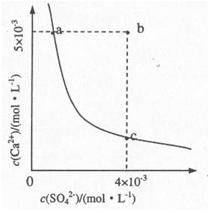
①向下脚料(含大量FeSO4溶液)中加入少量2 mo1·L-1叫H2SO4和铁皮;
②向①中所得溶液中加絮凝剂和水,经过滤除去吸附了杂质的絮凝剂;
③将②所得的滤液浓缩结晶得到晶体A;
④将晶体A溶于水,并加入NH4HCO3,产生CO2气体同时得到FeCO3沉淀和无色溶液C;
⑤将FeCO3沉淀洗涤、烘干并煅烧。(煅烧中的变化为:FeCO3="FeO+CO2↑;" 4FeO+O2="2" Fe2O3)
据上述信息回答下列问题:
(1)用18.4mo1·L-1的H2SO4配制500mL 2 mo1·L-1H2SO4,所需玻璃仪器除
mL量筒、玻璃棒、烧杯、500mI。容量瓶外,还需要。
(2)步骤①中2 mo1·L-1H2SO4和铁皮的作用分别为。
(3)晶体A的化学式为,检验溶液C中溶质阳离子的方法是。
(4)向溶液C中加入CaCl2溶液能得到CaSO4沉淀,常温下KSP(CaSO4)=9x10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。
①a点对应的KSPc点对应的KSP填“大于”、“小于”或“等于”);
②若由b点变到a点下列措施可行的是。
| A.加入适量CaCl2 | B.加入适量BaCl2. |
| C.加人适量Na2SO4 | D.蒸发 |
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数是内层电子数的2倍;其中只有C是金属元素,且C元素原子最外层电子数是D元素原子最外层电子数的一半;B元素原子的最外层电子数比D元素原子最外层电子数少一个;E与D同主族,且E元素的非金属性比D强。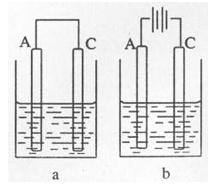
(1)写出A、B、E三种元素的元素符号:
A:B:E:。
(2)如图所示:以C和A的单质为电极材料,两池内的电解质溶液均为D的最高价氧化物对应的水化物。a中A为极,电池总反应的离子方程式为;b中A上的电极反应式为,一段时间后b中的pH(填“变大”、“变小”、或“不变”).
(3)工业利用CO(g)+H2O(g)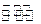 H2(g)+CO2(g)
H2(g)+CO2(g)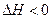 反应来制备合成氨的原料气,在1000℃下,用
反应来制备合成氨的原料气,在1000℃下,用
高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高温、高压处理的理由是。
(4)汽车内燃机工作时产生的高温会引起N2和O2的反应N2(g)+O2(g) 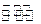 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
| 温度 |
27℃ |
2000℃ |
| K值 |
3.84×10-31 |
0.1 |
该反应为 反应(填“放热”、“吸热”);T℃时,该反应化学平衡常数K=1,当c(N2):c(O2):c2(NO)=1:1:l,则可逆反应的反应速率(v)应满足的关系为。
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法确定
下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。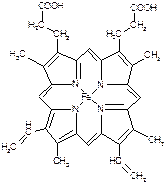
血红素的结构式
回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是 ▲,写出基态Fe原子的核外电子排布式 ▲。
⑵血红素中N原子的杂化方式为 ▲,在右图的方框内用“→”标出Fe2+的配位键。
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ▲,δ、α两种晶胞中铁原子的配位数之比为 ▲。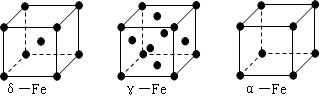
X(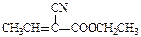 )是合成某种手术用粘合剂的单体,X的合成路线如下:
)是合成某种手术用粘合剂的单体,X的合成路线如下: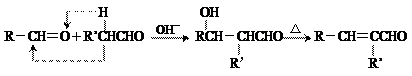
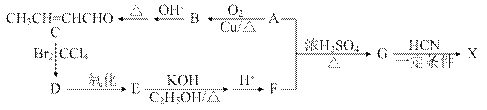
已知:
请回答下列问题:
⑴由单体X合成所得高分子粘合剂的结构简式是 ▲。
⑵物质C中所含官能团的名称是 ▲。
⑶写出由A→B的反应方程式: ▲。
⑷C→D、D→E的反应顺序能否颠倒并说明理由 ▲。
⑸C→D、A+F→G的反应类型依次为 ▲、 ▲反应。
⑹F的同分异构体中,属于酯类且含有“-C≡C-”结构,除了CH3COOC≡CH、 HCOOC≡CCH3外,还有的结构简式为 ▲、 ▲。
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l)△H1
H2NCOONH4(氨基甲酸铵) (l)△H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
 |
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol 氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
图Ⅰ图Ⅱ
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 ▲步反应决定,总反应进行到 ▲mi n时到达平衡。
n时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= ▲。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 ▲0(填“>”“<”或“=”)