某课外活动小组同学用图12装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体)。实验过程是:
①取一段镁带样品,准确称得其质量为0.030g。
②往量气管内装水至低于刻度“0”的位置。按图12所示(未装药品)装配好仪器。
③检查装置气密性。
④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞。
⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置。
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应。
⑦待冷却至室温后,再次记录量气管中液面位置。
⑧算出量气管中增加的气体体积为23.96mL。
已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。
请回答下列问题:
(1)写出镁与稀硫酸反应的化学方程式 。
(2)能否用托盘天平称量0.030g镁带样品 。(填“能”或“不能”)
(3)若不改变温度,如何用简单的方法检查图12所示装置的气密性?
(4)经换算,该实验获得的氢气质量为0.0020g。该镁带中单质镁的质量分数是 。
(5)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果 (填“是”或“否”)。理由是 。
实验与探究是化学学习的重要方法和内容。
(1)今年5月,我市各学校进行了实验操作考查。小张同学进行的实验考查是"用稀盐酸鉴别氢氧化钠(
)溶液和碳酸钠(
)溶液,并测定碳酸钠溶液的
"。
①小张同学的实验记录如下表,请补充完整:
| 操作步骤 |
现象记录 |
反应的化学方程式 |
| 取两支试管,分别往试管中加入2
样品1、2,再往其中滴入盐酸 |
样品1:无明显现象 |
|
| 样品2:溶液中出现气泡 |
②用
试纸测定碳酸钠溶液的酸碱度,简述操作的主要步骤:。
(2)在实验台上有三瓶未贴标签的溶液,已知分别是碳酸钠溶液、氢氧化钠溶液和稀盐酸。为区别这三种溶液,在老师指导下,兴趣小组的同学把这三种溶液按
、
、
进行编号,然后分别各取适量作为样品加入到三支试管中,进行了如下图所示的探究活动: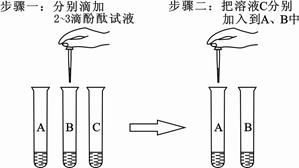
步骤一中,
无明显现象,
、
溶液的颜色变成红色;
步骤二中,
、
溶液的颜色由红色变成无色,且
溶液中有气泡冒出。
①根据上述实验现象可知,
、
溶液分别是、。
②某小组同学在进行步骤一实验时出现异常现象:往
溶液中加入酚酞试液时,溶液颜色先变成红色,振荡后迅速变成无色。老师指出这是因为溶液浓度过大造成的。接着,老师往该试管的溶液中加入适量盐酸,观察到
溶液的颜色又变成红色,此时溶液中含有的溶质主要是(酚酞除外)。
酸、碱、盐是几类重要的化合物,他们之间能发生复分解反应。
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有生成。
(2)某化学小组进行"酸和碱的中和反应"实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象。取反应后的部分溶液加热、蒸干、得到白色固体。
以下是探究白色固体成分的实验,已知
溶液呈中性。请填写下表:
| 实验操作 | 测定结果 | 白色固体成分 |
| 用 试纸测定反应后溶液的酸碱度,操作方法是 |
|
|
|
|
实验反思:无明显现象的中和反应可借助酸碱指示剂判断反应终点。
(3)"粗盐提纯"指除去
中的泥沙和
、
、
等杂质。
某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的
、
、
溶液,充分反应后过滤,蒸发结晶。请回答:
| 部分物质的溶解性表(室温) |
||||
| 溶、挥 |
溶 |
溶、挥 |
||
| 溶 |
溶 |
不溶 |
不溶 |
|
| 微溶 |
溶 |
微溶 |
不溶 |
|
| 不溶 |
溶 |
溶 |
微溶 |
①溶解、过滤和蒸发操作中都用到一种玻璃仪器,该仪器在蒸发操作中的作用是什么?
②加入
溶液的目的是什么?
③以上方案还需完善,请说明原因并加以补充。
(4)
和
的化学性质相似。"神舟"飞船内,可用盛有
的过滤网吸收航天员呼出的气体,以降低
含量。请计算:用
完全吸收176
生成
和
,理论上至少需要
的质量是多少?
乙炔 气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属.乙炔由碳化钙(块状固体,化学式为 )与水反应生成,同时生成一种白色固体.
【提出问题】白色固体是什么物质
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:
;
猜想二:;
猜想三:
.
他的依据是.
【交流反思】经过同学们交流讨论,认为猜想一不成立.否定猜想一的理由是:.
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到,证明猜想二不成立.
(二)取少量白色固体加入到水中,取上层清液,,有白色沉淀出现,证明猜想三成立.该反应的化学方程式为:.
结论:白色固体是
.
【拓展应用】已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小.实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装是(选填图中装置序号).
A B C D E F
化学小组同学为鉴定某工厂排出的无色污水成分,他们查阅工厂的有关资料后,推测出污水中可能含有
、
、
、
中的一种或几种物质,同学们取污水进行了探究:(已知
溶液呈中性)
(1)测污水的
:取一张
试纸,放在玻璃片上,读数为
,由此可知:污水中一定有,可能有
。
(2)检验
是否存在:甲同学在一支试管中取少量污水,向试管中滴加少量的溶液,振荡,产生了白色沉淀,反应的化学方程式为,证明污水中有
存在。乙同学用物理方法也得到了同样的结论,他的实验操作及实验现象是。
通过探究,同学们确定了污水的成分。
为使排放的污水中不含酸或碱,可向污水中加过量的。
同学们在实验室用5%的
溶液制取氧气并进行氧气性质实验。
溶液配制:用
30%的
溶液制取氧气(密度为1.13
)配制5%的
溶液(密度约为
)。溶液配制过程中,除用到玻璃棒外还需用到下列仪器中的。
| A. |
托盘天平 |
B. |
烧杯 |
C. |
漏斗 |
D. |
量筒 |
E. |
胶头滴管 |
气体制备:用配制好的5%
溶液和
制取
。请你在"
"、"
"两套装置中选择其中一套,并说明选择的理由,该反应的化学方程式为。待反应结束后同学们回收了混合物中的
,实验操作为。
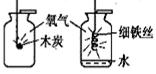
性质实验:小明用收集好的氧气,进行了下面的实验:
把点燃的木炭伸入集气瓶中,实验现象是;为使铁丝在氧气中持续剧烈燃烧,他把光亮的细铁丝盘成螺旋状,,缓慢插入集气瓶中,观察到持续剧烈燃烧。通过实验得出,氧气可以支持燃烧,并且可燃物燃烧更剧烈。