(本题的所有夹持仪器均已省略)请根据下图回答问题: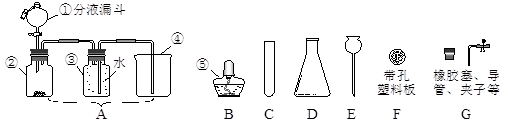
(1)图中仪器④⑤的名称:④ ,⑤ 。
(2)实验室制取氧气,某同学设计了图A的装置,并用仪器③收集氧气。其中,仪器①中盛放的试剂应为 ,此法生成氧气的化学方程式为 ,收集氧气的方法为 。
(3)实验室制取二氧化碳,从B~G中选择仪器,组装发生装置,要求能方便控制反应的发生或停止,你的正确选择为(填字母) ,反应的化学方程式为 。
(4)右图是氢气还原氧化铜的微型实验装置图。与上图A类比,眼药水瓶的作用相当于仪器(填仪器编号) 。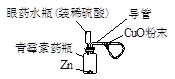
厨房中有一包无标识的白色粉末,经初步认定可能是氯化钠、碳酸钠、碳酸氢钠中的一种。小明对白色粉末的成分进行了探究。
[查阅资料]碳酸钠俗称、苏打,碳酸氢钠俗称小苏打,两者都属于(选填“酸”、“碱”、“盐”),都能溶于水,且水溶液都呈碱性。
[实验探究]小明取适量白色粉末,配制成溶液,按表中所示实验方案进行探究。
| 实验步骤 |
实验内容 |
实验现象 |
实验结论 |
| 1 |
取少量溶液,滴加无色酚酞溶液 |
溶液变红色 |
白色粉末肯定不是 |
| 2 |
取少量溶液,滴加稀盐酸 |
||
| 3 |
取少量溶液,滴加澄清石灰水 |
产生白色沉淀 |
(1)请完成表中空格。
(2)实验步骤2中可能发生反应的化学方程式为(写出一个即可)。实验步骤3中白色沉淀的成分是(填写化学式)。
[实验反思]小明实验后发现上述实验方案并不能确定白色粉末的组成。经老师指导后,小明再取少量配制的溶液滴加氯化钙溶液,没有观察到明显现象,则该白色粉末是。
(10分)某兴趣小组对物质的性质和成分进行相关探究。
(1)常见金属活动性顺序如下,填写相应的元素符号:
金属活动性由强逐渐减弱某同学用硫酸铜溶液把"铁刀变成铜刀",其反应的化学方程式为,该反应的基本反应类型为。
(2)兴趣小组同学用氧化铜与足量的炭粉利用图甲所示的装置进行实验,对生成气体的成分进行探究。
甲
[提出问题]生成的气体中是否含有一氧化碳?
[实验与讨论]
①打开
,缓缓通入干燥的氮气一段时间。
②关闭
,加热至一定温度使之反应,用气囊收集气体样品。
③除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列装置中最为合理的是。
[实验求证]
将除尽二氧化碳后的气体样品干燥,仍然用图甲所示的装置进行实验,
中的固体应选用,B中溶液为澄清石灰水,若
中黑色固体出现了红色,
中澄清石灰水,可说明气体样品中含有一氧化碳。
[实验反思]
炭粉还原氧化铜的实验中,若生成的气体中含有一氧化碳,则反应时消耗碳、氧元素的质量比(填"大于"、"等于"或"小于")3∶8。
实验室中的药品一般要密封保存,否则可能会与空气接触而变质。某研究性学习小组的同学对实验室里久置于空气中变质的过氧化钠(
)固体的成分进行探究。
[查阅资料]
(1) 的化学性质很活泼,能与水、二氧化碳反应,相关反应的化学方程式为:
(2)
溶液为中性
[猜想]I:固体为
、
、
的混合物
Ⅱ:固体为
和
的混合物
Ⅲ:固体为
Ⅳ:固体为
[实验探究]
| 实验操作 |
实验现象 |
实验结论 |
| ①取少量固体于试管中,加水振荡,直至完全溶解 |
猜想I不成立 |
|
| ②取少量①的溶液于试管中,滴加
溶液至过量 |
证明有
存在 |
|
| ③ |
证明有
存在 |
|
| 综合以上实验现象,说明猜想Ⅱ是成立的。 |
[反思评价]
(1)实验操作②中反应的化学方程式为
(2)实验操作②中"滴加 溶液至过量"的目的是
为探究气体
的组成,某兴趣小组进行图12所示实验(固定装置未画出)。
【资料在线】
(1)加热条件下,气体
能与氧化铜反应生成铜、水和氮气。
(2)碱石灰为固体氢氧化钠和氧化钙的混合物,不与气体
反应。无水氯化钙可吸收气体
。
(3)本实验条件下,氮气密度为
,装置内空气中的水与二氧化碳对相关数据测定的影响可忽略不计。
【实验步骤】
(1)连接仪器,并检查装置气密性。
(2)取一定量氧化铜,准确称得其质量为2.40
。
(3)按图12所示装入药品,测量并记录相关数据Ⅰ(见表1)。
(4)连接
装置,将气体
缓缓通入一段时间后,连接上
装置,读数后开始加热。当
装置中氧化铜反应完全,停止加热,继续通入气体
至玻璃管冷却,再次测量并记录相关数据Ⅱ(见表1)。
【实验装置】
【相关数据】
| 数据编号
测量项目 |
Ⅰ | Ⅱ |
| 玻璃管(含药品)的质量/ | 52.40 | 51.92 |
| B装置(含药品)的质量/ | 102.00 | 102.54 |
| 氮气的体积/ | / | 243.5 |
【回答问题】
(1)
装置中氧化钙吸水的原理为(用化学方程式表示)。
(2)实验过程中,当观察到,说明氧化铜已反应完全,停止加热,继续通入气体
至玻璃管冷却的目的是。
(3)分析实验测量的数据,生成水的质量为
,氧化铜中氧元素的质量为
。由此推知,气体
中一定(填"有"或 "没有")氧元素。
(4)通过计算推导出气体
的化学式。
有一种神奇的蜡烛,点一任你怎么吹也吹不灭,而且看上去和普通的蜡烛一模一样,那么到底是什么玄机能让蜡烛持续燃烧?请你一起参与探究.
查阅资料:普通蜡烛由石蜡和蜡烛芯制成,而吹不灭的蜡烛是在蜡烛芯上包裹一层打火石的粉末,打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只有150℃,当蜡烛燃烧时,金属并不燃烧;但当蜡烛吹灭后,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃.
老师告诉同学们,蜡烛芯内打火石中的某种金属可能是镁、铁或铜中的一种,为确定该金属的成分,大家设计了以下实验方案,请你填空和回答有关问题(注:不考虑打火石中稀土元素对探究金属性质的影响).
| 实验 |
操作步骤 |
实验现象 |
实验结论 |
| 1 |
切开蜡烛,取出打火石,用砂纸打磨 |
打火石呈银白色 |
该金属一定不是. |
| 2 |
取少量打磨后的打火石于试管中,滴加稀盐酸 |
有无色气体产生, |
该金属一定不是铁,而是镁 |
反思交流:
(1)实验2中反应的化学方程式为.
(2)这种蜡烛燃烧时,蜡烛芯里的金属为什么不燃烧?.
(3)这种"吹不灭"的蜡烛实际上也可以熄灭,你采用的方法是.