实验室中的药品一般要密封保存,否则可能会与空气接触而变质。某研究性学习小组的同学对实验室里久置于空气中变质的过氧化钠(
)固体的成分进行探究。
[查阅资料]
(1) 的化学性质很活泼,能与水、二氧化碳反应,相关反应的化学方程式为:
(2)
溶液为中性
[猜想]I:固体为
、
、
的混合物
Ⅱ:固体为
和
的混合物
Ⅲ:固体为
Ⅳ:固体为
[实验探究]
| 实验操作 |
实验现象 |
实验结论 |
| ①取少量固体于试管中,加水振荡,直至完全溶解 |
猜想I不成立 |
|
| ②取少量①的溶液于试管中,滴加
溶液至过量 |
|
证明有
存在 |
| ③ |
证明有
存在 |
|
| 综合以上实验现象,说明猜想Ⅱ是成立的。 |
[反思评价]
(1)实验操作②中反应的化学方程式为
(2)实验操作②中"滴加 溶液至过量"的目的是
大明和小明发现市场上有些食品装在充满气体的塑料袋内,显得鼓鼓的。经询问得知:这样充气的包装,主要是为了使食品能较长时间保鲜、保质和不易压碎。那么,这是什么气体呢?大明猜想是二氧化碳,小明猜想是氧气。
(1)假设大明的猜想正确,请你用实验方法证明(要求写出操作步骤和实验现象)
(2)假设小明的猜想正确,请你用实验方法证明(要求写出操作步骤和实验现象)
(3)你认为食品充气包装中,对所充气体的要求是(写出两点):
① ,② 。
(4)根据⑶中要求,你认为(填"大明"或"小明")的猜想正确。
某同学为了研究竹子里面气体的成分,做了一个实验。
(1)他先将竹子浸在水里,钻个小孔,看到一串串气泡冒出。然后采用法(填实验室常用的一种集气方法)收集到了甲乙两瓶气体。
(2)将放有足量红磷的燃烧匙伸入甲瓶中(如图)。用放大镜聚焦,使红磷燃烧,瓶内充满了白烟。然后,将甲瓶倒放水中,松开夹子,结果流入的水约占瓶子容积的1/10。这说明竹子里的气体中肯定含有。
(3)再往乙瓶中倒入一些澄清石灰水,发现石灰水马上变浑浊。这说明竹子里的气体中肯定含有。
(4)那么竹子里的气体含量与空气有什么区别呢?于是,他又用空气重复了上述实验。相比较后得出的结论是:。
同学们通过实验来验证Cu、Fe、Ag三种金属的活动性顺序。实验室提供的药品有:Cu(NO3)2溶液、AgNO3溶液、Fe(NO3)2溶液、稀盐酸、铜丝、铁丝、银丝。
(1)小华同学设计并完成了如下实验:
①把铁丝插入装有稀盐酸的试管中;②把铜丝插入装有稀盐酸的试管中;
③把银丝插入装有稀盐酸的试管中;④把铜丝插入装有AgNO3溶液的试管中。
观察到①中的实验现象是,④中的化学方程式是。你认为小华所做的实验(填序号)是多余的。
(2)后来,小贝只选用了上述药品中的三种,通过两步实验,也达到了实验目的。他选用的三种药品是(写出一种药品组合即可)。
小贝还想探究Zn、Fe、Cu的活动性顺序,设计了如图的两个实验:小贝以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是。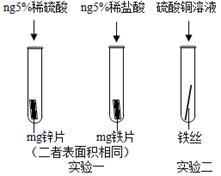
(一)小明和小亮同学在实验室帮老师配制石灰水时,将两药匙熟石灰样品放入小烧杯中,向其中加入一定量的蒸馏水,充分搅拌后发现烧杯底部仍有不溶性的固体,于是小明认为熟石灰样品已经变质。小亮同学不同意他的判断,你认为小亮同学的理由 。同学们针对该熟石灰样品的成分展开了讨论,请你参与讨论并完成实验报告。
【提出问题】熟石灰样品的主要成分是什么?
【作出猜想】甲同学猜想是Ca(OH)2;
乙同学猜想是CaCO3
你认为是 。
【实验与结论】请你通过实验验证你的猜想:
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量的熟石灰样品于烧杯中,加适量的水充分溶解后过滤。 向滤液中加入适量的 溶液; |
; |
乙的猜想不正确 |
| 向滤出固体中加入适量 溶液。 |
。 |
你的猜想正确 |
【拓展与应用】小组同学反思了熟石灰变质的原因,认识到实验室应 保存熟石灰。
(二)在做盐跟盐反应的分组实验时,第一组学生进行BaCl2与Na2CO3溶液的反应,第二组学生进行BaCl2与Na2SO4溶液的反应。实验结束后,两组同学将全部的浊液集中倒进一个废液缸中。浊液中白色沉淀物质是 和 。(填物质的化学式)
化学兴趣小组对浊液进行过滤,探究滤液的成分。
【提出问题】滤液里除了NaCl外,还有什么物质?
【提出猜想】猜想①: ;猜想②:Na2SO4;
猜想③:Na2CO3;猜想④:Na2CO3、Na2SO4
【实验探究】
若现象a只有气泡产生,则猜想 可能成立;若现象b产生白色沉淀,然后加稀硝酸沉淀部分溶解,若沉淀全部不溶解,则猜想 成立。
小明同学对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】
a.可能与硫酸的质量分数有关;
b.可能与锌的形状有关。
【查阅资料】
锌的化学性质比较活泼,在常温下的空气中,表面生成一层“保护膜”,可阻止进一步氧化。该“保护膜”可以和酸反应,但不产生氢气。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 |
硫酸的质量分数(均取20mL) |
锌的形状(均取1g) |
氢气的体积(mL)(均收集3分钟) |
| ① |
20% |
锌粒 |
31.7 |
| ② |
20% |
锌片 |
50.9 |
| ③ |
20% |
锌粒 |
61.7 |
| ④ |
30% |
锌片 |
79.9 |
(1)写出稀硫酸与锌反应的化学方程式______________________________。
(2)小兵用图装置收集并测量氢气的体积,其中量筒的作用是_______________________,氢气应从________(填e或f或g)管通入;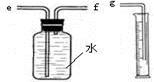
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是____________;
【得出结论】
(4)结论是_____________________________________________________;
【评价与反思】
(5)下表是小兵第①组实验的详细数据。
| 时段(均为1分钟) |
第1分钟 |
第2分钟 |
第3分钟 |
第4分钟 |
第5分钟 |
第6分钟 |
| H2的体积 |
3.1mL |
16.7mL |
11. 9mL |
9.6mL |
7.6mL |
6.0mL |
请描述锌与硫酸反应的先慢后快最后又变慢的原因___________________________;
(6)你认为锌与硫酸反应的快慢可能还受因素影响?
(7)取某厂生产的生铁样品6g,与100g足量的稀硫酸充分反应后,称得剩余物质的总质量为105.8g。
①生成气体的质量为克;
②该厂生产的生铁样品中铁的质量分数是多少?(写出具体的过程,结果精确到0.1%)
③该厂生产的生铁是否合格?(填“合格”或“不合格”)