(本题共12分)下表四组物质中,每组均有4个备选项,其中有1个选项与另外3个选项属于不同的分类,请把该选项的序号挑选出来,并说明你的挑选依据,分别填入下表相应空格内。
| 组别 |
备选项 |
不同分类选项 |
挑选依据 |
| (1) |
A.CO B.CO2 C.SO2 D.P2O5 |
|
|
| (2) |
A. 食盐水 B.浑浊的河水 C. 带有飘尘的空气 D. 二氧化碳气体 |
|
|
| (3) |
A. CaO B.SO2 C. Na2O D. CuO |
|
|
| (4) |
A. H2SO4 B. H2CO3 C.NaH2PO4 D. HNO3 |
|
|
已知X、Y、Z三元素的质子数都小于18且依次增大,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y形成的单质是空气的主要成分,则
(1)写出元素符号:X是、Y是、Z是
(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的离子
有(写出离子符号,只要写出2种)
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式是
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如右图:
(1)如果把电键K接A,这一装置形成_________装置,Zn①极是________极,其电极反应式是_____ _ ______;Zn②极上的电极反应式是____________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是__________极,该装置发生反应的总化学方程式是___________________________;
(3)上述装置进行2min后,再转换电键K到B,在Zn②极上发生的腐蚀属于_________,被腐蚀的金属是_____,Zn①极发生的腐蚀主要属于____________。
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为__(填序号)。
| A.9 | B.13 | C.11~13之间 | D.9~11之间 |
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中
c(Na+)_______c(CH3COO-) ( “>”、“=”或“<”)。
(3)常温下,0.10mol/LNH4Cl溶液中各离子浓度由大到小的顺序是______________。
(4)将NaHCO3溶液跟Al2(SO4)3溶液混合,现象是,相关反应的离子方程式是。
.在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 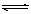 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=。已知:K300℃>K350℃,则该反应是热反应。
(2)右图中表示NO2的变化的曲线是。用O2表示从0~2s内该反应的平均速率v=。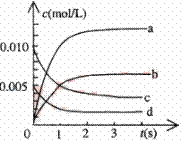
(3)能说明该反应已达到平衡状态的是。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正 (O2)d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
已知下列两个热化学方程式:
H2(g)+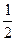 O2(g)====H2O(l)△H=-128.5kJ·mol-1
O2(g)====H2O(l)△H=-128.5kJ·mol-1
C3H8(g)+5O2(g)====3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1
(1)实验测得H2和C3 H8的混合气体共5 mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3 H8的体积比是;
(2)已知:H2O(l) H2O(g)△H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式。
H2O(g)△H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式。