已知:A酸的溶液pH=a,B碱的溶液pH="b "
(1)若A为盐酸,B为氢氧化钠,且a+b=14,二者等体积混合,则溶液的pH= 。若酸碱按体积比为1:10混合后溶液显中性,
则a+b= 。
(2)若A为醋酸,B为氢氧化钡,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol·L-1,B溶液中水电离出的氢离子浓度 为 。mol·L-1
(3)若A为醋酸,B为氢氧化钠,且a+b=14,将体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB,
混合后溶液中的离子浓度关系为c(Na+) c(CH3COO-)
(填“<”“>”或“=”)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,
其水解反应的离子方程式为 。
煤燃烧的反应热可通过以下两个途径来利用:A.利用煤在充足的空气中直接燃烧产生的反应热;B.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)====CO2(g) ΔH=E1①
b.C(s)+H2O(g)====H2(g)+CO(g) ΔH=E2②
H2(g)+1/2O2(g)====H2O(g) ΔH=E3③
CO(g)+1/2O2(g)====CO2(g) ΔH=E4④
完成下列问题:
(1)与途径a相比途径b有较多的优点,即_________________________。
(2)上述四个热化学方程式中的哪个反应的ΔH>0?___________________。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用总能量关系正确的是________。
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为_________________________。
近20年来,对于氢能源的研究获得了迅速发展,像电一样,氢是一种需要依靠其他能源如石油、煤、太阳能等的能量来制取的所谓的“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为一级能源,如煤、石油、太阳能和原子能等。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是_______________。
| A.电解水 | B.锌和稀硫酸反应 |
| C.光解海水 | D.以石油、天然气为原料 |
(2)氢气燃烧时耗氧量小,发热量大。已知碳和氢气燃烧的热化学方程式为:
C(s)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+1/2O2(g)====H2O(l) ΔH=-285.8 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是_______________。
(3)氢能源有可能实现能源的贮存,也可能实现经济、高效的输送。研究表明过渡金属的氢化物(又称间充氢化物)中,氢原子填充在金属的晶格间隙之间时,其组成不固定,通常是非化学计量的,如LaH2.76、TiH1.73、Ce H2.69。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g·cm-3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式_________________。
大麻酚及它的衍生物都属麻醉药品,并且毒性较强。吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中。吸食大麻还可破坏男女的生育能力,而且由于大麻中焦油含量高,其致癌率也较高。大麻酚分子结构为
回答下列问题:
(1)大麻酚的分子式为__________。
(2)写出大麻酚燃烧的化学方程式:______________________________________________。
(3)大麻酚属酚类化合物,写出大麻酚与NaOH及足量溴水的反应产物__________。
吗啡和海洛因都是严格查禁的毒品。吗啡分子中C、H、N、O的质量分数分别为71.58%、6.67%、4.91%和16.84%,又知其相对分子质量不超过300。则吗啡的相对分子质量为__________,分子式为______________________________。
现有乙酸、苯、苯酚、苯甲酸四种有机物组成的混合物,可按右面的图示程序进行分离(已知苯甲酸是微溶于水的白色晶体)。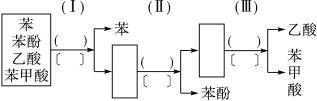
请在圆括号内填上适当的试剂名称,在方格号内填上分离操作的名称,在方框内填上适当物质的化学式。