哈尔滨市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50 mg/kg |
| 分装日期 |
|
| 分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及上述步骤中的位置是_________________________________。
(3)已知:I2+2S2O32- = 2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液
10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_________________mg/kg。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为。
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为N2+3H2 2NH3,则在电化学合成氨的过程中,阳极反应式为,阴极反应式为。
2NH3,则在电化学合成氨的过程中,阳极反应式为,阴极反应式为。
(3)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与t的关系如下表:
2NH3(g)△H<0,其化学平衡常数K与t的关系如下表:
| t/K |
298 |
398 |
498 |
…… |
| K/(mol·L-1)-2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题:
①试确定K1的相对大小,K14.1×106(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是(填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B.2v(NH3)(正) =3v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是。
②某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为()
A.[Cl-]>[NH4+]>[H+]>[OH-]
B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]>[NH4+]>[OH-]>[H+]
D.[NH4+]>[Cl-]>[H+]>[OH-]
已知方框内是食品香精菠萝酯的生产路线,A、B又能发生方框外所示的转化关系。A、B、C的分子式分别C2H3ClO2、C8H8O3、C3H6O。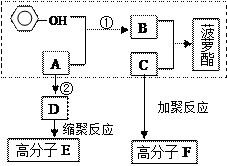
信息:-OH和碳碳双键不能连在同一个碳原子上。
根据所给信息完成以下问题:
⑴写出指定的结构简式:B;E。
⑵反应①属于反应(填反应类型);反应②进行的条件是:。
⑶1mol菠萝酯最多能与mol H2发生加成反应。
⑷写出生成高分子F的化学方程式:。
⑸写出满足下列条件的B的同分异构体:属于酯类;能使FeCl3溶液显色;苯环上只有两个取代基且处于对位。、、、(有几种填写几种)。
A、B、C、D是原子序数依次增大的四种短周期元素,又知A、D同主族且能形成两种不同化合物,B、C同周期,A、B、C的简单离子具有相同的核外电子排布,B、C的最高价氧化物对应的水化物可以生成盐和水。试完成以下问题:
⑴在A和D的低价氢化物中,熔点较高的是(写化学式),其原因是。
⑵A、B、C、D四种元素的简单离子的半径由大到小的顺序是(填离子符号)。
⑶写出C和D两种元素形成化合物与水反应的化学方程式。
⑷B、D两元素形成的化合物的水溶液显性,用离子方程式解释其原因:
。
(12分)2008年9月25日我国“神七”成功发射,标志着我国载人航天技术迈出重要的一步。“神七”以N2H4和N2O4燃料,N2H4学名为肼又称联氨,无色油状液体,具有与氨相似的气味,毒性很大。
⑴水电离成H3O+和OH-叫做水的自偶电离。同水一样,N2H4也有微弱的自偶电离,其自偶电离的方程式为:。
⑵氨显碱性的原因在于NH3分子中的N原子具有孤对电子,它能通过配位键结合水中的H+,使水电离出OH-,其过程可以表示为NH3+H2O NH4++OH-。试问N2H4与足量盐酸反应的化学方程式:。
NH4++OH-。试问N2H4与足量盐酸反应的化学方程式:。
⑶已知硼酸[B(OH)3]为一元弱酸,其显示酸性的原理与NH3、N2H4显示碱性的原理类似,试用离子方程式表示其显示酸性的过程:。
⑷N2H4和N2O4反应温度达2700摄氏度,产生无污染的气体。1g液态N2H4与足量的液态N2O4充分反应生成两种气态物质,可放出a KJ热量,试写出该反应的热化学方程式:
。
英国国家海洋学中心于2009年8月14日发布新闻公报说,中心的研究人员及其同行利用声呐等手段探测到北极海洋中存在大量甲烷气泡,证实了全球变暖会使海底释放大量甲烷的说法。研究人员认为,这些甲烷可能会反过来加剧全球变暖。


(1)右图是1molCH4和O2完全反应生成CO2气体与水蒸气过程中能量变化示意图,又已知 H2O(l)=H2O(g) △H=44.0kJ·mol-1,请写出1molCH4和O2完全反应生成CO2气体与液态水的热化学方程式。
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,氢气虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。电池的构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
①请写出甲烷燃料电池中a极的电极反应式为。
②此时电池内的总反应方程式为。
(3)某课外活动小组利用右图所示装置探究甲烷于氯气的反应。根据题意,回答下列问题:
①CH4与Cl2发生反应的条件是;若用日光直射,可能会引起。
②实验中可观察的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出,,等。
③用饱和食盐水而不用谁的原因是。
④实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应化学方程式为2CHCl3+O2→2COCl2+2HCl,上述反应(填选项符号,下同)
A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
A.氢氧化钠溶液 B.硝酸银溶液 C.稀盐酸
D.水 E.湿润的蓝色石蕊试纸F.湿润的无色酚酞试纸