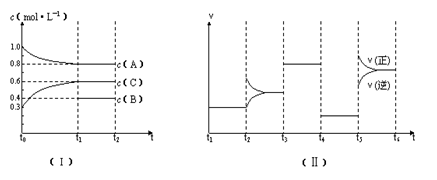
.向一定体积的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应,各物质的量浓度随时间变化如图(Ⅰ)所示,其中t0--t1阶段c(B)未画出。图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化 的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、压强、温度、催化剂中的一个条件,其中t3---t4阶段为使用催化剂。
的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、压强、温度、催化剂中的一个条件,其中t3---t4阶段为使用催化剂。
请回答下列问题:
(1)若t1="15" min,则t0---t1阶段以C物质的浓度变化表示的反应速率为 mol·  L—1·min—1。
L—1·min—1。
(2)t4--t5阶段改变的条件为 ,B的起始物质的量浓度为 mol· L—1。
(3)t5----t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中的热效应为a kJ热量,写出此温度下该反应的热化学方程式

(10分)某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液.回答下列问题: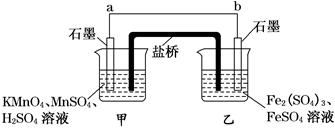
(1)发生氧化反应的烧杯是________(填“甲”或“乙”).
(2)外电路的电流方向为:从________到________.(填“a”或“b”)
(3)电池工作时,盐桥中的SO42-移向________(填“甲”或“乙”)烧杯.
(4)甲烧杯中发生的电极反应为______________________________________________.
(1)某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-、HB- H++B2-回答下列问题:在0。1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
H++B2-回答下列问题:在0。1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=2c(Na+)
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(2)下表为几种酸的电离平衡常数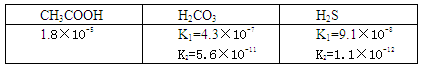
则pH相同的CH3COONa、Na2CO3、NaHS溶液物质的量浓度由大到小的顺序,少量CO2与NaHS反应的离子方程式为。
已知下列两个热化学方程式:
H2(g)+  O2(g)====H2O(l) ΔH="-285" kJ·mol-1
O2(g)====H2O(l) ΔH="-285" kJ·mol-1
C3H8(g)+5O2(g)====3CO2(g)+4H2O(l) ΔH="-2" 220.0 kJ·mol-1
(1)实验测得H2和C3H8的混合气体共5 mol,完全燃烧生成液态水时放热6264.5 kJ,则混合气体中H2和C3H8的体积比是__________。
(2)已知H2O(l)====H2O(g) ΔH=+44.0 kJ·mol-1
写出丙烷燃烧生成CO2和气态水的热化学方程式____________________________________________。
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g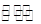 2NO(g)ΔH>0,已知该反应在2 404 ℃时,平衡常数K=64×10-4。
2NO(g)ΔH>0,已知该反应在2 404 ℃时,平衡常数K=64×10-4。
请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率________。
(2)假设该反应是在恒容条件下进行,判断该反应达到平衡的标志________。
| A.消耗1 mol N2同时生成1 mol O2 |
| B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 |
| D.2v(N2)正=v(NO)逆 |
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________(填字母序号)。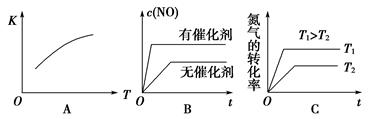
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数______。(填“变大”、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2mol/L和3.0×10-3 mol/L,此时反应________________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是__________________________________________________________。
(20分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡:
(1)有0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为。
(2)有0.1 mol·L-1的NaHCO3溶液,在该溶液中存在的平衡有三个,请分别用离子方程式表示:
____________________、__________________________、。
(3)已知25℃时Ksp[Mg(OH)2]=1.2×10-11,KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,则最先生成的沉淀的离子方程式为
。
(4)NH3·H2O 的电离方程式是,往氨水中加入少量醋酸铵固体(提示醋酸铵呈中性),C(OH-)(填“增大”“减小”“不变”)。
(5)已知某温度下K(NH3·H2O)=1.69×10-5,
则该温度下0.1mol/L的氨水中C(OH-)= mol/L
(6)又已知该温度下Ksp〔Mg(OH)2〕=1.2×10-11,
将0.01mol/L的MgCl2溶液与上述氨水等体积混合(填“有”“无”)沉淀生成。往0.01mol/L的MgCl2溶液中滴加氢氧化钠溶液至pH="10" 此时C(Mg2+)=mol/L。