X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表。
| 元素 |
性质或结构信息 |
| X |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
| Y |
二价阳离子的外围电子层排布为3d9 |
| T |
原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
| Q |
第三周期主族元素中原子半径最小。 |
请根据上述信息回答下列问题:
⑴ 写出 X3- 的一种等电子体的化学式 ; X的气态氢化物易液化的原因是: 。
⑵写出T元素基态原子的核外电子排布图 ;
Q元素的原子核外有 种运动状态不同的电子。
⑶元素 X 、T 的电负性相比, 的小(填元素名称);元素 X 的第一电离能与T相比较,T的 (填“大”或“小”)。
⑷甲醛(CH2O)分子中σ 键与π 键的个数之比为 。
⑸Y元素在周期表中位于 区。Y单质晶体的晶胞如右图所示,
该晶胞中实际拥有 个原子,该晶体中Y原子在三维空间里的
堆积方式为 堆积。
⑹在Y的硫酸盐溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。此蓝色沉淀溶解的离子方程式为: 。
⑺元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为: ,分子中X原子的杂化方式为 杂化。
下表是元素周期表的一部分,请回答有关问题:
IAⅡAⅢA ⅣA VAⅥA ⅦA 0
1 a b
2 c d e f g
3 h i j k l
4 m n
(1)a元素与d元素形成的化合物的电子式:_____________________;
(2)用电子式表示mn化合物的形成过程_________________________;
(3)属于稀有气体的是__________(填元素符号,下同);
(4)将等物质的量的k元素的单质通入FeBr2溶液中,发生反应的离子方程式是:___________________________,该反应的氧化剂是:__ _____________(写物质名称);
(5)表中能形成两性氢氧化物的元素是_______,写出其氢氧化物与h的氢氧化物的水溶液反应的离子方程式____________________________________________;
(1)电解精炼铜阳极的主要反应是,还会发生的反应有(任写一个)。
(2)电解精炼铜的阳极泥中含有铜和金、银等贵重金属及稀有金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如下: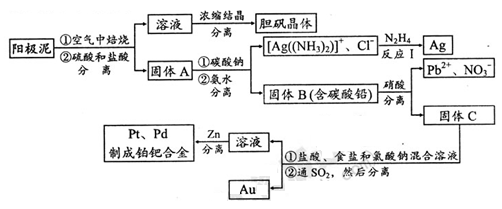
请回答下列问题:
①各步生产流程中都涉及了同一种分离方法,实验室中不能用这种方法来分离液态胶体中分散质与分散剂的原因是。
②用硝酸处理固体B中碳酸铅的离子方程式是。
③反应I中肼(N2H4)的作用是。
④固体C用盐酸、食盐和氯酸钠混合溶液处理后得到H2PtCl6、AuCl3、PdCl2。反应中每消耗lmol氧化剂要转移mol e-;在AuCl3溶液中通入SO2生成单质金,当生成19.7gAu时,25℃和101kPa下反应消耗L SO2(此条件下的气体摩尔体积为24.5L/mol)。
苯乙酮(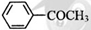 )是最简单的芳香酮,它是制备药物、调味剂、有机高聚物和催泪瓦斯等的中间体。合成苯乙酮有如下两条路线:
)是最简单的芳香酮,它是制备药物、调味剂、有机高聚物和催泪瓦斯等的中间体。合成苯乙酮有如下两条路线: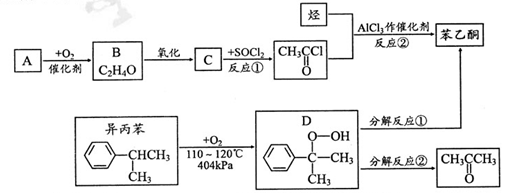
(1)A的结构简式为;苯乙酮分子中官能团的名称是。
(2)反应①的反应类型是;反应②的化学方程式为。
(3)D很不稳定.可以发生合成路线中的两种分解反应生成另一种产物。写出D分解后的另一种物质的结构简式:分解反应①;分解反应②。
(4)写出同时符合下列条件的苯乙酮的同分异构体的结构简式。
①属芳香族化合物;②能发生银镜反应;③苯环上一取代物有4种。
(5)异丙苯具有的化学性质有。(填编号)
a.能催化加氢
b. 能使酸性高锰酸钾溶液褪色
c.在催化剂作用下与液溴发生取代反应
d. 能与乙醇反应生成芳香醚
e.能与饱和溴水发生取代反应
X、Y、Z、W是元素周期表中前四周期四种常见的元素。已知:W基态原子有7个轨道填充了电子;Y与Z原子最外层的电子数相同,但Y的原子半径比Z小;ZY2和Y3都具有漂白性,它们分子的空间构型都是V型;X的合金在生活中有非常广泛的用途,X分别与Y、Z形成化合物甲、乙,在甲、乙中X的质量分数分别为72.4%和63.64%;丙是由X、Y、Z三种元素组成的一种常见的还原剂,在溶液中反应1个阳离子失去1个电子。
(1)W基态原子的最外层(价层)的电子排布式为;X3+最外层电子数为;Y、Z、W三种单质与Y、W两元素形成的化合物四种物质的熔点从高到低的排序是。(填化学式)
(2)写出在溶液中,丙与酸性高锰酸钾反应的离子方程式:。
(3)检验ZY2的方法是(写出操作步骤和实验现象)。
(4)高温下甲与W单质剧烈反应。在25℃、101kPa下测得每转移3mol e-放热416.4kJ该反应的热化学方程式是。
(1)实验室在配制氯化铁溶液时,常出现少许浑浊,原因离子方程式表示为 。为防止出现这样的现象,在配制时常加入
(2)根据下列2个热化学反应方程式:
FeO(s)+CO(g)=" Fe(s)+" CO2(g)△H= ―218kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H= +640.5kJ/mol
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:
______________
(4)常温下,等物质的量的浓度的①氨水②NH4HSO4③NH4Cl④(NH4)2CO3
⑤(NH4) 2SO4溶液中,c(NH4+)由大到小的顺序为_____________________________(填序号)