物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_______________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的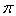 键有________mol。
键有________mol。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金化学式为;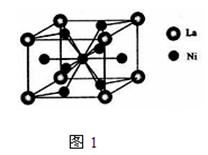
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟Ni2+反应可生成鲜红色沉淀,其结构如图2所示:
①该结构中,碳碳之间共价键是σ键,碳氮之间共价键是,氮镍之间形成化学键是;
②该结构中,氧氢之间除共价键外还可存在;
③该结构中,碳原子杂化轨道有
下图为某药物合成路线的一部分。
(1)A→B的化学方程式为,E中的含氧官能团名称为、。
(2)若②的反应历程经历了中间产物 ,则该反应历程先后经历的反应类型为、。试剂X的结构简式为。
,则该反应历程先后经历的反应类型为、。试剂X的结构简式为。
(3)写出两种满足下列要求的D的同分异构体的结构简式,。
①分子中有4种化学环境不同的氢原子;
②可发生水解反应,一种产物可发生银镜反应,另一种能与FeCl3发生显色反应;
③分子中的氯原子不与苯环直接相连。
物质净化对生产生活很重要的意义。
(1)除去水中的 Ca2+,Mg2+等阳离子,完成此目标可使用____(填材料名称)。
(2)催化还原法可以净化硝酸工业尾气,下列物质中不能用于除去尾气中氮氧化物的是________(填字母序号)。
| A.NH3 | B.CH4 | C.CO2 | D.H2 |
(3)接触法制硫酸的工艺中,沸腾炉产生的炉气必须经过净化,除去其中的粉尘和______,净化后的炉气进入_____(填设备名称)。
(4)煤的气化技术的主要产物是______,将煤加热以得到焦炉气、煤焦油及焦炭等产品的技术称为___________ 。
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性CB(选填“>”“<”),第一电离能N>O,原因是。
(3)月球岩石玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为,其中硫原子采用杂化,氧原子的价电子排布图为,任意写出一种SO42-等电子体。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示。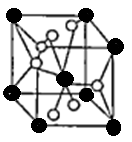
则该氧化物的化学式(图中钛原子用“O”表示。氧原子用“O”表示)
避蚊酯(DMP)是一种塑化剂.相对分子质量为194,摄人后对人体有一定的危害,其结构可表示为 (其中R为烃基)实验室由以下方法可得到DMP
(其中R为烃基)实验室由以下方法可得到DMP
请回答:
(1)物质C中官能团的名称为。
(2)下列有关DMP的说法可能正确的是。(填字母标号)
A.DMP的分子式为C10H12O4
B.DMP可以发生取代、加成、氧化等反应
C.DMP在水中的溶解度不大
(3)B与乙二酸(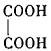 )在一定条件下可以按物质的量1:1发生反应生成高分子化合物,该高分子化合物的结构简式为。
)在一定条件下可以按物质的量1:1发生反应生成高分子化合物,该高分子化合物的结构简式为。
(4)工业上以邻二甲苯(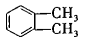 )为原料先生产苯酐(
)为原料先生产苯酐(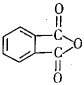 ),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为。
),再使其与某醇在一定条件下反应制取DMP。苯酐与该醇制取DMP的化学方程式为。
(5)芳香化合物E与C互为同分异构体,若lmo E与足量银氨溶液反应最多生成2mol Ag,则E可能的结构简式为。B也存在多种同分异构体,符合下列条件的B的同分异构体有种。
①l mol有机物可以与2mol NaOH反应
②苯环上的一氯代物只有一种。