下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在③~⑦元素中,原子半径最大的是 ,其离子的原子结构示意图为
(2)元素的最高价氧化物对应的水化物中酸性最强的是 , 呈两性的氢氧化物是 ;
(3)按要求写出下列两种物质的电子式:①的氢化物 ;⑨的最高价氧化物的对应的水化物 ;
(4)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): 。
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或者“否”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。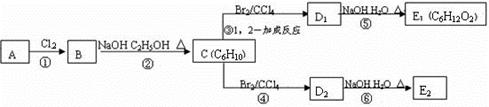
反应②的化学方程式为;C的化学名称是;
E2的结构简式是;④、⑥的反应类型依次是。
2000 年,国家药品监督管理局发布通告暂停使用和销售含苯丙醇胺的药品制剂。苯丙醇胺(英文缩写为PPA)结构简式如下: 其中φ代表苯基。苯丙醇胺是一种一取代苯,取代基是
其中φ代表苯基。苯丙醇胺是一种一取代苯,取代基是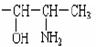
(1)PPA 的分子式是:_______________________。
(2)它的取代基中有两个官能团,名称是_________基和________基(请填写汉字)。
(3)将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,其中5 种的结构简式是:
请写出另外4 种同分异构体的结构简式(不要写出-OH 和-NH2 连在同一个碳原子上的异构体;写出多于4 种的要扣分):
______________、______________、______________、______________。
实验室做乙醛和银氨溶液反应的实验时:
(1)为了得到光亮的银镜,试管应先用溶液煮沸,倒掉煮沸液体后再用蒸馏水将试管冲洗干净。
(2)配制银氨溶液时向盛有溶液的试管中逐滴滴加溶液,边滴边振荡,直到为止。有关反应的化学方程式为:①;②。
(3)加热时应用加热。产生银镜反应的化学方程式。
(1)设计一个简单的一次性完成实验的装置,验证醋酸、二氧化碳水溶液(碳酸)和苯酚的酸性,其强弱的顺序是:CH3COOH> H2CO3> C6H5OH
①利用下列仪器可以组装实验装置,则仪器的连接顺序是:。
②写出实验过程中发生反应的离子方程式。、。
(2)若1 mol 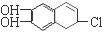 分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是mol和mol。
分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是mol和mol。
(1)南京“青奥会”已进入倒计时,体育场馆和城市交通建设日臻完善。
①体育场馆建设需大量建筑材料。下列材料不属于硅酸盐材料的是(填字母)。
a.石灰石 b.水泥 c.玻璃
②轨道交通建设需大量金属材料。下列金属材料最易发生腐蚀的是(填字母)。
a.铝合金 b.钢铁 c.纯铜
③“塑胶”跑道是由聚氨酯橡胶等材料建成。聚氨酯橡胶属于(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
(2)“青奥会”期间,要保障运动员的营养与健康。
①及时补充体能是运动员取得优秀成绩的基本保证。六大基本营养素中能在人体内氧化供能的有糖类、和。
②水果和蔬菜富含VC。已知VC的结构为 ,其分子式为
,其分子式为
;在氯化铁溶液中加入VC溶液后,溶液由黄色转变为浅绿色,说明VC具有较强的____性。
③服用违禁药物不仅妨碍体育竞技的公平、公正,也有害运动员的身心健康。在阿斯匹林、青霉素、麻黄素、小苏打等常用药物中,参赛选手不可服用的是。
(3)“绿水蓝天”工程为运动员提供优良环境,向世界展示古都南京的美好形象。
①PM2.5指悬浮于大气中的直径≤2.5μm(微米)的颗粒物,大量PM2.5会造成灰霾天气,危害人体健康。燃煤气化有助于控制PM2.5的含量,写出焦炭与水蒸气反应的化学方程式。
②汽车尾气中含有污染大气的NO和CO。给汽车排气管加装“催化转化器”,可使CO和NO反应生成无毒无污染的气体,反应的化学方程式为。装有“催化转化器”的汽车必须使用无铅汽油,其原因是。
③含铬元素的废水必须治理达标。某兴趣小组探究含铬(Cr2O72ˉ)废水的处理方法,经查阅资料,拟采用(NH4)2Fe(SO4)2将Cr2O72ˉ还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该方案运用了污水处理方法中的氧化还原法和。指导老师指出该方案处理后的废水中因含有大量(填离子符号),能导致水体富营养化。