A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同。
(1)画出E的原子结构示意图 ,
(2)2014年10月24日,我国探月工程三期再入返回飞行试验器在西昌卫星发射中心由长征三号丙运载火箭发射升空。长征三号丙运载火箭使用的推进剂之一是A与B形成含有18电子的化合物甲,另一推进剂为B与C结合形成的一种红棕色气体乙。则甲与乙反应的化学方程式为 。
(3)D与C按原子个数比为1:1形成化合物丙与水反应的离子方程式 。
(4)B、C所形成氢化物的稳定性由强到弱的顺序是 (填具体的化学式)。
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与 C按原子个数比为1:1形成的化合物丁反应的离子方程式 。
(6)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,放电时溶液中H+移向 (填“正”或“负”)极。
向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至过量。
(1)写出可能发生的有关反应的化学方程式。。
(2)在图中,纵坐标表示生成沉淀的物质的量,横坐标表示加入Ba(OH)2的物质的量。试在图中画出当溶液中明矾为1 mol时,生成的每一种沉淀的物质的量随Ba(OH)2物质的量变化的曲线(在曲线上标明沉淀的化学式)。
(3)向a L物质的量浓度为M mol/L的明矾溶液中滴加物质的量浓度为n mol/L的Ba(OH)2溶液b L,用含a、M、n的表达式表示:
①当b满足________条件时,沉淀的总物质的量为最大值;
②当b满足________条件时,沉淀的质量为最大值。
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
A的单质是密度最小的物质 |
| B |
B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C |
C的原子最外层电子数是其内层电子数的三倍 |
| D |
D与B同周期,该周期中D的简单离子半径最小 |
| E |
B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F |
F元素最高正价与最低负价的代数和为4 |
(1)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式
(2)D、E、F的简单离子半径由大到小的顺序是(直接用化学式表示)。
(3)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解。向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等。则原混合物中D单质的质量分数
为。
(4)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。此时反应的化学方程式为。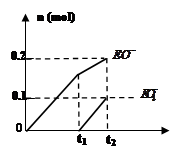
(5)A、B形成的化合物BA在有机合成中用途很广泛。它可以夺取很多化合物中的质子而生成相应的钠的化合物。写出它与乙醇反应的化学方程式。
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O--KH(IO3)2+KCl+Cl2↑(未配平)
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:______________________________________________________________;
(2)步骤②中,用稀酸酸化的作用是____________________________________________;
不选稀盐酸的原因是;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是。
| 温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
| KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、Ag+、Mg2+、Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出0.56L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是。
(2)实验I中生成沉淀的离子方程式为。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定
不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由。
中学常见反应的化学方程式是:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,该反应的离子方程式是。
(2)若A为常见的非金属单质,B的溶液为某浓酸,其氧化产物的结构式为 ______
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是(填所在周期和族)
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,被还原的X
是mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为。