现有一固体粉末可能含有NH4Cl、NH4NO3、Na2CO3、CuSO4、NaOH和K2SO4中的一种或几种,为鉴定其成分,实验步骤和现象如下:
①固体粉末有刺激性气味。②取少量样品置于试管中,加适量水溶解,得到无色溶液。
③取适量上述溶液, 滴加Ba(NO3)2溶液,产生白色沉淀,过滤,往沉淀中滴加稀硝酸,沉淀完全溶解。
滴加Ba(NO3)2溶液,产生白色沉淀,过滤,往沉淀中滴加稀硝酸,沉淀完全溶解。
④取适量上述溶液,加入AgNO3溶液后产生白色沉淀,再滴加稀硝酸,沉淀不溶解。
回答以下问题:
⑴过滤操作中用到的玻璃仪器是 (写出两种)。
⑵原固体粉末中一定含有 ;可能含有 ;一定不含有 。
某化学小组同学利用以下三组装置探究燃烧条件。
图1图2图3
(1)如图1所示,能燃烧的物质是(填字母序号),燃烧反应的化学方程式为。
A.水中的白磷 B.铜片上的白磷C.铜片上的红磷
(2)如图2所示,将液体a滴入瓶中并与固体b接触,能观察到白磷燃烧,则瓶内发生反应的化学方程式为。
(3)如图3所示,在空气中放置时,两团棉花均不燃烧;若将足量二氧化碳倒入烧杯时,可以观察到的现象有:①;②粘有过氧化钠的棉花燃烧;③未粘有过氧化钠的棉花不燃烧。通过上述实验的对比分析,写出产生现象②的原因。
完成三组实验之后,同学成功探究出了燃烧所需要的条件。
为探究四瓶未知无色溶液的成分,甲、乙、丙三组同学分别设计了如下实验。已知四种溶液分别是Na2CO3、NaOH、Ca(OH)2和稀盐酸中的一种。
【实验过程】
甲组实验方案:将四瓶溶液标号分别为1、2、3、4,只利用紫色石蕊溶液进行实验。
| 实验步骤和操作 |
实验现象和结论 |
||
(1)如图所示: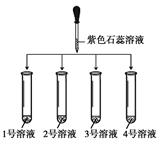 |
① 2号溶液由无色变为红色, 则2号溶液是 ② 另三支试管中溶液均由无色变蓝色 |
||
(2)另取1、3、4号溶液,分别滴加2号溶液
|
① 3号溶液中有气泡放出, 则3号溶液是 ② 另外二支试管中溶液无明显变化 |
||
| (3)另取1、4号溶液,分别滴加 |
①1号溶液中有白色沉淀析出, 则反应的化学方程式为 ② 另一支试管中溶液中无明显变化 |
乙组实验方案:不用其他试剂进行实验。
| 实验操作 |
实验现象 |
实验结论 |
任取三种溶液于三支试管中,分别滴加第四种溶液 |
①一支试管中有气泡放出 其余二支试管中溶液无明显变化 |
① 第四种溶液为稀盐酸 |
| ② 一支试管中有白色沉淀析出, 其余二支试管中溶液无明显变化 |
② 第四种为Na2CO3溶液 |
|
| ③ 三支试管中溶液均无明显变化 |
③ 第四种为NaOH溶液 |
【实验分析】
经过交流后,发现实验结论 (填序号)是不正确的;若该结论作正确,对应的实验现象应是 。
丙组实验方案:将四种溶液编号为1、2、3、4,不用其他试剂进行实验。
| 实验操作 |
实验现象 |
实验结论 |
||
如图所示:
|
①A、B、C均无明显变化 ②D中有沉淀析出 |
标号为1、2、3、4的溶液依次为(用化学式表示): 或 |
某化学小组对“SO2能否与H2O反应生成酸”的课题开展探究。
【查阅资料】
(1)SO2有毒,常温下是一种无色气体,易溶于水。
(2)酸能使蓝色的石蕊试纸变成红色。
【实验过程】
(1)常温下,实验室用稀硫酸与固体亚硫酸钠反应制取SO2。下列气体的制备装置能用于制备SO2的是(填序号)。
A.加热高锰酸钾制氧气
B.稀盐酸与大理石反应制二氧化碳
C.过氧化氢分解(二氧化锰作催化剂)制氧气
(2)右图A中,实验时,A中蓝色石蕊试纸的颜色始终没有变化,由此得出的结论是。
(3)右图B中,在通入SO2之前,将滴管内的水滴到试纸上,试纸颜色没有发生变化,
由此得出的结论是,当有SO2通过时,湿润的蓝色石蕊试纸变红,由此得出的结论是。
(4)该实验中尾气处理的方法是:将其通入溶液中。
根据下列三组实验回答问题。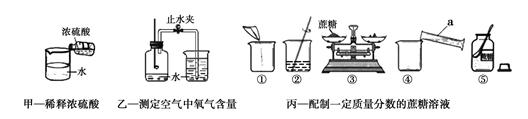
(1)图中仪器a的名称是;三组实验都用到的玻璃仪器是。
(2)指出甲实验中不正确的操作。
(3)乙实验中,燃烧匙中装入的药品应为,其反应的实验现象是。
(4)丙实验中,正确的操作顺序为(填序号):⑤→→→→ ②。
通过半年的化学学习,你对化学实验有了一些认识,请你解答下列问题:
(1)在电解水的实验中,两电极相连的玻璃管上方产生的气体是和,两者的体积比约为,这个实验证明了水是由组成。该反应的化学方程式为。
(2)根据下图所示实验装置回答下列问题: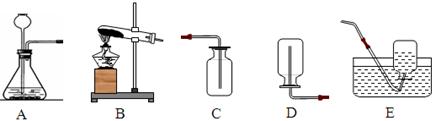
①用氯酸钾和二氧化锰混合加热制取O2应选用的发生装置(填序号,下同)____;若用高锰酸钾加热制取O2该装置还需做的一点改动是;用过氧化氢溶液和二氧化锰混合制取O2应选用_________;制取H2应选用__________;
制取CO2应选用_______,反应的化学方程式为。 ②收集O2可选用________, 理由是; 收集CO2应选用。(3).过滤操作中的要点常简记为“一贴二低三靠”,请你解释“三靠”的具体含义:。
“三靠”:①,② ,
③。