为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验:①向5ml 5%的稀盐酸中加入0.5g锌;②向5ml 10%的稀盐酸中加入0.5g锌;③向5ml 5%的稀盐酸中加入0.5g锌,并将其温度升至50℃。下列说法正确的是 ( )
| A.对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响 |
| B.对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响 |
| C.对比实验①和②,可研究温度对反应剧烈程度的影响 |
| D. |
根据下图回答问题。
(1)仪器a的名称是。
(2)实验室制取二氧化碳应选用的发生装置是(填装置代号,下同),收集装置是________,将___________接近集气瓶口,若观察到木条熄灭,说明二氧化碳已收集满。
(3)若用装置A、C制取氧气,反应的化学方程式为。收集完氧气后,应先将导管移出水槽,再熄灭酒精灯,其目的是_________________。
请根据下列表述回答问题:
(1)已知A、B、C、D均含有两种元素。固体A中加入液体B,能放出大量热。固体C中加入液体D,有气泡产生,充分反应后过滤,只得到液体B和固体C。
①A跟B反应的生成物可用于改良酸性土壤或用于建筑材料等,则A的化学式为________。
②C跟D发生反应的化学方程式为________。
(2)固体E、F和液体G、H四种物质中,任意一种固体与任意一种液体混合均有气泡产生。E通过其它反应能生成F。
①若E为单质,E、F的化学式可能为(写一组即可)。
②若E和F均含三种元素,E生成F的化学方程式为。固体E和二氧化硅在高温条件下可生成硅酸钠(Na2SiO3)和一种能产生温室效应的常见气体,该反应的化学方程式为:。
铁和铜是生产生活中常见的金属.
(1)能有效防止铁制品生锈的措施是_______
| A.家用水龙头镀铬 | B.汽车表面喷漆打蜡 |
| C.自行车链条涂油 | D.菜刀用后洗净擦干 |
(2)回收利用是保护金属资源的一条有效途径。某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液,主要流程如下。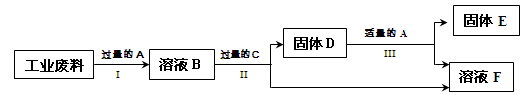
已知: CuO + H2SO4 CuSO4 + H2O Fe + Fe2(SO4) 3 3FeSO4
① 过程Ⅰ中氧化铁溶解的化学方程式是________。
② 过程Ⅱ充分反应后,还应有的实验操作是_______,该过程中发生的化学反应基本类型是(填类型名称)。
③过程Ⅲ加入适量A的作用是________;该过程中的实验现象是________。
④A~F中含铁元素的有(填序号)。
溶液在日常生活及工农业生产上具有广泛的用途。
(1)医疗上常用0.9%NaCl溶液作生理盐水,生理盐水中的溶质是。
(2)配制500 g生理盐水,需要的仪器为(填序号)。
(3)已知KCl的溶解度20°C时为34 g,40°C时为40 g。某实验小组做了如下实验。
①B所得溶液中溶质与溶剂的质量比为;
② A~E所得溶液中,没有固体剩余的饱和溶液是(填序号,下同),溶质的质量分数相等的是。
5分)地球大气的演化经历了原始大气、次生大气和现在大气。
(1)现在大气的成分是在千万年前固定下来的,主要成分是氮气和氧气,现在大气属于(填“混合物”或“纯净物”)。
(2)原始大气的主要成分是氢气,氢元素原子的核外电子数为1,其质子数为。
(3)次生大气主要成分的微观示意图如下所示。
①A、B、C、D、E五种物质中属于有机物的是(填序号)。
②太阳远紫外辐射能穿透上层大气到达低空,使D物质发生分解反应,生成B物质和氧气,该反应的化学方程式为。
③在一定条件下,3.4 g C物质和 4.8 g氧气恰好完全反应,生成 5.4 g D物质和另一种物质,则该物质是(填序号)。
A.N2 B.NO C.NO2 D.N2O5