洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为: 。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5 g甲醇(CH3OH,液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式:。
(2)已知化学键的键能为:
| 化学键 |
H—H |
N—H |
 |
| 键能/( kJ·mol-1) |
436 |
391 |
945 |
又知反应N2(g)+3H2(g) 2NH3(g) ΔH="a" kJ·mol-1。试根据表中所列键能数据估算a的值为。
2NH3(g) ΔH="a" kJ·mol-1。试根据表中所列键能数据估算a的值为。
(3)已知:C(石墨,s)+O2(g) CO2(g) ΔH="-393" kJ·mol-1
CO2(g) ΔH="-393" kJ·mol-1
2H2(g)+O2(g) 2H2O(l)ΔH=-571.6 kJ·mol-1
2H2O(l)ΔH=-571.6 kJ·mol-1
2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l)ΔH="-2599" kJ·mol-1
4CO2(g)+2H2O(l)ΔH="-2599" kJ·mol-1
根据盖斯定律,计算298 K时C(石墨,s)和H2(g)反应生成1 mol C2H2(g)的焓变为。
(12分)在100 ℃时,将0.100 mol N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| c(N2O4)/mol·L-1 |
0.100 |
c1 |
0.050 |
c3 |
c4 |
| c(NO2)/mol·L-1 |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为________;从表中分析:
c1________c2,c3________c4(填“>”、“<”或“=”)。
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1。
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是________(填字母序号)。
A.扩大容器的容积
B.再充入一定量的N2O4
C.分离出一定量的NO2
D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为________。
如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题: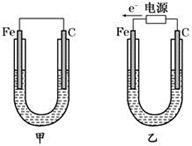
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的________棒,乙装置中的________棒。
②乙装置中阳极的电极反应式是:_______________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:_____________________________。
②甲装置中碳极的电极反应式是,乙装置碳极的电极反应属于________(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:。
为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格。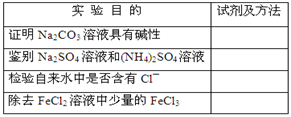
供选择的化学试剂及实验方法
| A.加入足量铁粉,过滤 |
| B.滴加酚酞试液,观察现象 |
| C.加稀HNO3和AgNO3溶液,观察现象 |
| D.加入NaOH浓溶液加热,观察现象 |
化学兴趣小组为探究某铁矿石(主要成分为Fe2O3和SiO2)的性质,进行如下实验: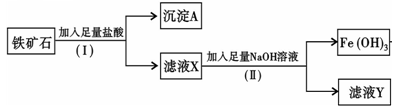
(1)步骤(I)中分离溶液和沉淀的操作名称是;
(2)沉淀A中一定含有,该物质属于(填“酸性”或“碱性”)氧化物;
(3)往滤液Y中加入KSCN溶液,溶液呈(填“黄色”或“红色”)
(4)写出步骤(Ⅱ)中生成Fe(OH)3的离子方程式。