化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5 g甲醇(CH3OH,液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式: 。
(2)已知化学键的键能为:
| 化学键 |
H—H |
N—H |
 |
| 键能/( kJ·mol-1) |
436 |
391 |
945 |
又知反应N2(g)+3H2(g) 2NH3(g) ΔH="a" kJ·mol-1。试根据表中所列键能数据估算a的值为 。
2NH3(g) ΔH="a" kJ·mol-1。试根据表中所列键能数据估算a的值为 。
(3)已知:C(石墨,s)+O2(g) CO2(g) ΔH="-393" kJ·mol-1
CO2(g) ΔH="-393" kJ·mol-1
2H2(g)+O2(g) 2H2O(l)ΔH=-571.6 kJ·mol-1
2H2O(l)ΔH=-571.6 kJ·mol-1
2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l)ΔH="-2599" kJ·mol-1
4CO2(g)+2H2O(l)ΔH="-2599" kJ·mol-1
根据盖斯定律,计算298 K时C(石墨,s)和H2(g)反应生成1 mol C2H2(g)的焓变为 。
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作完成问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动;另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶完后,溶液中[H+]/[CH3COOH]的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)。(填“大于”、“小于”或“等于”,下同)
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)________V(乙)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)________c(CH3COO-)。
(5)取25 mL的乙溶液,加入等体积pH=12的氨水,反应后溶液中的溶质为_________________
(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
| A.[Na+]>[Cl-]>[OH-]>[H+] |
| B.[Na+]=[Cl-]>[H+]>[OH-] |
| C.[Na+]=[Cl-]>[OH-]>[H+] |
| D.[Cl-]>[Na+]>[OH-]>[H+] |
(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1 ______C2(填“<”、“=”或“>”)
按下图装置进行实验,并回答下列问题
(1)判断装置的名称:A池为
(2)锌电极反应式为__________________
石墨棒C1为______极,电极反应式为__________
石墨棒C2附近发生的实验现象为______________
(3)当C2极析出2.24L气体(标准状态)时,锌的质量减少了__g.CuSO4溶液的质量增加了______g
(1)某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。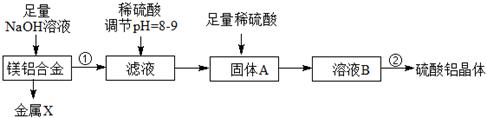
则镁铝合金中加NaOH溶液的化学反应方程式为,金属X是,
固体A的化学式,操作②包含的步骤有蒸发浓缩、、过滤、干燥。
(2)某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称,需要测定的数据有。(已知该实验时的温度压强)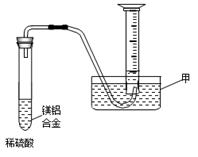
(3)现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+的物质的量之和为0.10 mol,若向此溶液加入170 mL 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。
在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰。H可用于制造光导纤维,J是一种乳白色凝胶状沉淀。(部分生成物和部分反应条件未列出)
请回答下列问题:
(1)A的电子式为。
(2)H的化学式为。
(3)写出反应①的离子方程式。
(4)写出反应②的化学方程式。