一定温度下,将3mol A气体和1mol B气体通入一密闭容器中,发生如下反应:3A(g)+B (g) xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4 mol·L-1。
①则1min内,B的平均反应速率为_________,x=_________;
②若反应经2min达到平衡,平衡时C的浓度_________0.8 mol·L-1 (填“大于”、“等于”或“小于”);
③若平衡混合物中C的体积分数为22%,则A的转化率是_________;
④若改变起始物质的加入量,欲使反应达到平衡时C的物质的量分数与原平衡相等,则起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的条件_________(可用两个方程表示,其中一个用n(A)和 n(C),另一个用n(B)和n(C)表示)。
(2)若维持容器压强不变。
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②若改变起始物质的加入量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入______molA气体和_______molB气体。
口服抗菌药利君沙的制备原料G、某种广泛应用于电子电器、家用品等领域的高分子化合物I的合成路线如下:
已知:①R—CH2—CH=CH2 R—CHCl—CH=CH2
R—CHCl—CH=CH2
②R—CH2—CH=CH2 R—CH2CH2CH2CHO
R—CH2CH2CH2CHO
A的结构简式是___________________,D中的官能团的名称是______________。
写出B→C的反应方程式___________________,该反应类型是______________。
H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯取代物只有一种,写出H的结构简式___________________。
写出E+H→I的反应方程式________________。
J是比C多一个碳原子的C的同系物,J可能的稳定结构有______种(两个官能团同时连在同一个碳上的结构不稳定),任意写出其中一种的结构简式_______________。
关于G的说法中正确的是___________(填序号)。
a.1 mol G最多可与2 mol NaHCO3反应
b.G可发生消去反应
c.1 mol G最多可与2 mol H2发生加成反应
d.G在光照条件下可与Cl2发生取代反应
化工生产中涉及较多的化学原理、生产方法和工艺流程,请回答下列问题:
(1)工业上用硫铁矿生产硫酸的主要设备有__________、__________、__________。
(2)工业上制备硫酸,常采用__________(填编号)为吸收剂,以高效吸收三氧化硫。
a.自来水 b.蒸馏水 c.稀硫酸 d.98.3%硫酸
(3)侯氏制碱法中,用二氧化碳和氨气与饱和食盐水反应制碳酸氢钠,应先向饱和食盐水中通入_____。
(4)石油裂化分为热裂化、催化裂化和_______,其目的为__________________。
(5)为降低电解液熔点,工业上生产铝时需要加入的熔剂为____________________。
某实验小组用工业废弃固体(主要成分为Cu2S和Fe2O3)制备有关物质,整个流程如下图所示。请回答: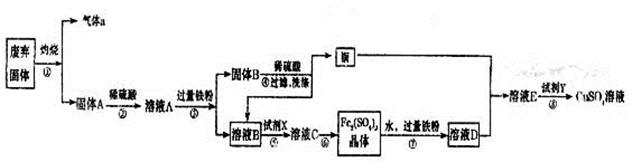
(1)气体a的化学式为。
(2)溶液B加入硫酸酸化后再加入适宜氧化剂X得到溶液C,写出该反应的离子方程式。
(3)制备硫酸铜溶液。常温下,O2、铜粉和稀硫酸三者在一起,几乎不反应,当加入溶液D后,随即生成硫酸铜。经理阅资料发现FeSO4对铜的氧化起催化作用。
A.第一步反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,则第二步反应的郭子方程式为。
B.⑦操作中,配制Fe2(SO4)3溶液时应注意。
(4)操作⑧的目的是得到较纯的硫酸铜溶液。加入适宜试剂Y调节pH至铁元素全部沉淀(离子浓度小于10-5mol/L),然后再过滤,浓缩、结晶等,则pH至少调节为_____。
已知:Ksp[Cu(OH)2]≈1×10-22,Ksp[Fe(OH)2] ≈1×10-16,Ksp[Fe(OH)3] ≈1×10-38
(5)科学家发现纳米级的Cu2O在太阳光照射下可以催化分解水。
A.一定温度下,在2L密闭容器中加入纳米级Cu2O,通入2mol水蒸气,发生如下反应:
2H2O(g)=2H2(g)+O2(g)△H=+484kJ/mol
20min末测得n(O2)=0.16mol,则这段时间的反应速率υ(H2)=_________;该温度下,此反应的平衡常数表达式K=___________________。
B.已知:2Cu2O(s)+O2(g)=4CuO(s)△H=-292kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221kJ/mol
请写出炭粉还原CuO(s)制备Cu2O(s)的热化学方程式_________________。
氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为。
②BH—4的空间构型是(用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢。下列说法正确的是(多项选择)。
2NH3实现储氢和输氢。下列说法正确的是(多项选择)。
a.NH3分子中N原子采用sp3杂化
b.相同压强时,NH3沸点比PH3高
c.[Cu(NH3)4]2+离子中,N原子是配位原子
d.CN—的电子式为: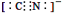
(3)2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子。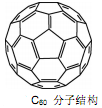
①C60晶体易溶于苯、CS2,说明C60是分子(选填:“极性”、“非极性”);
②1mol C60分子中,含有σ键数目为。
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag·cm-3,则晶胞的体积为cm3[用a、NA表示阿伏加德罗常数]。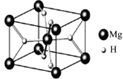
利用转炉煤气[CO(60~80%)、CO2(15~20%)及微量N2等]及硫酸工业尾气中的SO2,既能净化尾气,又能获得保险粉(Na2S2O4),其部分工艺流程如下: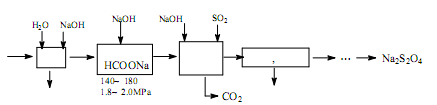
(1)转炉炼钢时,存在反应: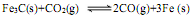 ,其平衡常数表达式为K=。
,其平衡常数表达式为K=。
(2)煤气净化时,先用水洗再用NaOH溶液洗涤,其目的是。
(3)从滤液中回收甲醇的操作方法是;还可回收的盐类物质是(只写一种化学式)。
(4)合成保险粉反应的化学方程式为。
(5)保险粉、H2O2均可用于纸桨漂白剂,写出保险粉与过量的H2O2在水溶液中反应生成硫酸盐等物质的离子方程式。