(9分)乙炔(HC≡CH)是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成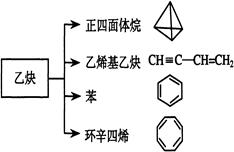
以下化合物。完成下列各题:
(1)正四面体烷的分子式为 ,其二氯取代产物
有 种
(2)关于乙烯基乙炔分子的说法错误的是
| A.能使酸性KMnO4溶液褪色 |
| B.1mol乙烯基乙炔能与3molBr2发生加成反应 |
| C.乙烯基乙炔分子内含有两种官能团 |
| D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同 |
(3)写出与环辛四烯互为同分异构体且属于芳香烃的结构简式
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):
、
黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的示意图如下: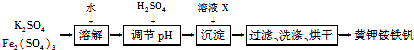
(1)溶液X是________。
(2)检验滤液中是否存在K+的操作是________________________。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224 mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾的化学式(写出计算过程)。
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题: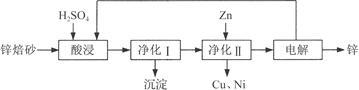
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为___________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________。
②25 ℃时,pH=3的溶液中,c(Fe3+)=________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________。
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是_________________。
⑷本流程中可以循环利用的物质除锌外还有________________。
具有光、电、磁等特殊功能的新型材料是目前化学研究的热点之一,二硫醇烯与锌的配合物(C)的一种合成途径如下。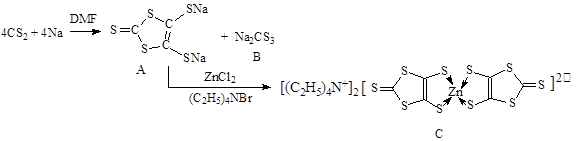
(1)锌原子基态时核外电子排布式为。
(2)下列说法正确的是(不定项选择)。
a.金属钠的熔点比金属锂高
b.金属钠晶体属于面心立方堆积
c.CS2的沸点比CO2高
d.硫化钠晶胞(如图所示)中含4个S2-离子
(3)化合物B中CS32-的空间构型是(用文字描述)
(4)配合物C中Zn2+的配位数是(填数字),N原子杂化方式是。
(5)1mol化合物A中含有σ键的数目为。
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ·mol-1,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是(写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图所示。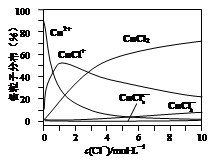
①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为(任写一个)。
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O  ZnFe2O4+2CO2↑+4CO↑+6H2O ……………(b)
ZnFe2O4+2CO2↑+4CO↑+6H2O ……………(b)
(1)上述制备原理中属于氧化还原反应的是(选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ、(NH4)2Fe(SO4)2·6H2O,Ⅱ、ZnSO4·7H2O及Ⅲ、(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n(Zn2+)=。
②选用的加料方式是(填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,然后升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成配制溶液乙,甲、乙同时加热到75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤完全的依据是。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有和。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息利用实验可提供的试剂制取纯净的ZnSO4溶液。
实验中可选用的试剂如下:
(a)30%H2O2;(b)新制氯水;
(c)1.0 mol·L-1NaOH溶液;
(d)3mol·L-1稀硫酸;
(e)纯ZnO粉末;
(f)纯锌粉。
实验步骤依次为:①将锌片完全溶于稍过量的3mol·L-1稀硫酸,加入(选填字母,下同);②加入;③加热到60℃左右并不断搅拌;
④过滤得ZnSO4溶液。其中步骤③加热的主要目的有。