(12分) 在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(1)写出实验室制取NH3的化学方程式 。
(2)实验室制取、收集干燥的NH3 ,需选用上述仪器装置的接口连接顺序是(选填字母):a接 , 接 , 接h;
,需选用上述仪器装置的接口连接顺序是(选填字母):a接 , 接 , 接h;
(3)用如图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用(选填字母编号);
| A.碱石灰 | B.生石灰 | C.无水氯化钙 | D.无水硫酸铜 E.烧碱 |
(4)向浓CaCl2溶液中通人NH3和C02气体制纳米级碳酸钙时,应先通人的气体是 ,试写出制纳米级碳酸钙的化学方程式 ;
(5)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
完成以下实验:①用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。试回答下列问题:
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 、 (写出两种有机物的结构简式)。
(3)溴乙烷的沸点较低,易挥发,为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,上图中采取的措施有 、 _。
(4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。用下图装置进行实验的目的是 _;下图中右边试管中的现象是 ;水的作用是 。
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
Ⅰ:在试管中加入3 mL 1 mol/L NaOH溶液和3 mL 溴乙烷,振荡,加热。
(1)设计实验证明上述实验中溴乙烷里的Br变成了Br-
(需说明:简单的实验操作及预测产生的实验现象)。
(2)观察到 现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是 和 。
II:在试管中加入3 mL NaOH乙醇溶液和3 mL 溴乙烷,振荡,加热。
设计实验证明上述实验中溴乙烷发生的是消去反应
(需说明:简单的实验操作及预测产生的实验现象)。
一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159g/cm3,熔点为-97.73℃,沸点为-24.2℃,18℃时在水中的溶解度为280mL/mL水,与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室里可用下图装置制造一氯甲烷: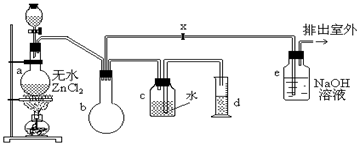
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。
试填写下列空白:
(1)制备一氯甲烷的化学方程式 ,其反应类型属于 反应;
(2)装置b的作用是 ;
(3)已知卤代烃能发生碱性水解,转化为醇。装置e中可能发生的反应方程式为 ;
(4)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别)。CH3Cl燃烧的化学方程式是 ;
(5)实验中实际按甲醇和浓盐酸1︰2(物质量之比)进行反应的理由是 ;
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇~
浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是 ;
(7)实验结束后,d中收集到的液体中含有 。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下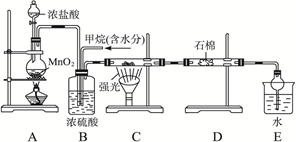
根据要求填空:
(1)B装置有三种功能:①______________;②____________;③_______________。
(2)设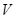 (Cl2)/
(Cl2)/ 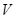 (CH4) =
(CH4) =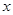 ,若理论上欲获得最多的氯化氢,则
,若理论上欲获得最多的氯化氢,则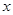 值的取值范围为___________。
值的取值范围为___________。
(3)D装置的石棉中均匀混有KI粉末,其作用是___________________。
(4)E装置的作用是_______________(填编号)。
A.收集气体B.吸收氯气
C.防止倒吸D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 。
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)。
A.CH4
B.CH3Cl
C.CH2Cl2
D.CHCl3
E.CCl4
图2是研究甲烷取代反应实验装置图,具体的实验方法是:
取一个100 mL的大量筒,先后收集20 mL CH4和80 mL Cl2,进行实验。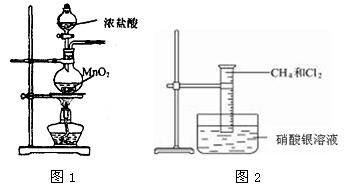
(1)实验室制取氯气的装置如上图1所示,请写出烧瓶中的反应方程式为: 。浓盐酸在反应中体现了 性和 性。
(2)下列常用的干燥剂中,不能干燥氯气的是 。
| A.浓硫酸 | B.P2O5 | C.无水氯化钙 | D.碱石灰 |
(3)氯气是 色的有毒气体,实验中剩余的氯气可用NaOH溶液吸收,请写出发生的离子方程式: 。
(4)若研究甲烷与氯气的取代反应,还需要的条件是___________。若将如图2所示装置放在强光下照射会有_________________(填可能发生的不良后果)。
(5)若量筒中的甲烷和氯气的量比较大,放在光亮的地方足够长的时间,下方水槽中的现象是_________________,产生此现象的原因是:______________________(用简要的文字和方程式说明)。