利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下
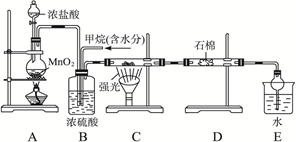
根据要求填空:
(1)B装置有三种功能:①______________;②____________;③_______________。
(2)设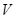 (Cl2)/
(Cl2)/ 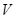 (CH4) =
(CH4) =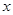 ,若理论上欲获得最多的氯化氢,则
,若理论上欲获得最多的氯化氢,则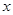 值的取值范围为___________。
值的取值范围为___________。
(3)D装置的石棉中均匀混有KI粉末,其作用是___________________。
(4)E装置的作用是_______________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 。
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)。
A.CH4
B.CH3Cl
C.CH2Cl2
D.CHCl3
E.CCl4
从固体混合物A出发可以发生如下框图所示的一系列变化。
(1)在实验室,气体C的检验方法是。
(2)操作②的名称是,该操作所使用的玻璃仪器有。
(3)写出下列反应的离子方程式:
反应③;
反应④。
实验中多余的气体I必须吸收,以免污染空气。下图是实验室用NaOH吸收气体I的装置,为防止产生倒吸现象,不合理的装置是(填序号)。
某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。
(1)步骤1所需玻璃仪器是;步骤3的操作名称是
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1: 只含有氯化钠
假设2: 只含有
假设3: 氯化钠和氢氧化钠都含有
(3)设计实验方案,对假设3进行检验。
限选以 下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
②入过量试剂A的名称是_______________________。
②填写下表:
| 实验步骤 |
预期现象和结论 |
| 步骤4: |
|
| 步骤5: |
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中存在Fe2+,需要进行的实验操作、现象和结论是。
乙同学认为气体Y中除含有SO2、H2外,还可能含有CO2气体。为此设计了下列探究实验装置。图中夹持仪器省略,M中盛有澄清石灰水。
①认为气体Y中还含有CO2的理由是(用化学方程式表)。
②装置A中试剂的作用是。
③为确认CO2的存在,需在装置中添加M于(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
④能说明气体Y中含有H2的实验现象是。
实验室需要450ml 0.12mol/L的NaOH溶液,有如下操作:
①把称好的NaOH放入小烧杯中,加适量蒸馏水溶解。
②根据计算用托盘天平称取NaOH克。
③把①所得溶液小心转入一定容积的容量瓶中。
④继续向容量瓶中加蒸馏水至液面距刻度线1cm-2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
⑤用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑥将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
⑴上述步骤中要称量的NaOH固体为克
⑵操作步骤的正确顺序为(填序号)。
⑶实验室有如下规格的容量瓶:①100mL ②250mL ③500mL ④1000mL,本实验选用
(填序号)。
⑷本实验用到的基本实验仪器除托盘天平,药匙以外还有:。
⑸误差分析:(填“偏高”、“偏低”或“无影响”)
①称量NaOH固体时,物码倒置(1克以下用游码)
②没有进行操作步骤⑤
③容量瓶中原来有少量水
④某同学定容时俯视容量瓶刻度线
⑤定容,摇匀后发现液面低于刻度线,拿胶头滴管又加入蒸馏水使液体凹液面再次与刻度线相切。
常温下,某工厂以浓硫酸、浓硝酸、粗铜、水和空气为原料,设计如图所示制取硫酸铜晶体(CuSO4·5H2O)的生产工序和流程。
回答下列问题:
(1)(I)中制取硫酸铜的总反应的化学方程式为。
(2)在上述反应中可以被循环利用的物质为(写化学式)。
(3)①某同学在实验室中模拟上述生产过程实现上述方案,请根据该同学的思路在下列装置中选用适当的装置,并将它们的编号填入方框内。
②装置C的作用是。
(4)硫酸铜晶体也可以直接用浓硫酸和粗铜反应制取,与上述方法相比,其缺点是。