I.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式__________________________________________________。
(2)某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白: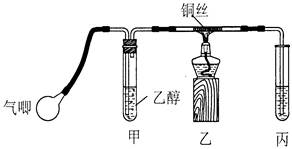
(1)乙醇发生催化氧化的化学反应方程式为________________________________________。
(2)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是____________________;由于装置设计上的缺陷,实验进行时可能会______________________________。
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。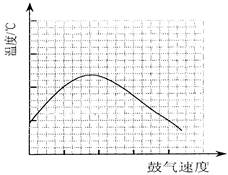
试解释出现图中现象的原因:______________________________;你认为该实验中“鼓气速度”这一变量可用______________________________来计量。
某溶液中含有Ba2+、Cu2+、Ag+、Mg2+等四种金属阳离子,现欲将这四种阳离子逐一沉淀下来。某学生设计了如下四种方案。所选试剂及顺序如下:
甲方案:Na2SO4溶液、稀盐酸、H2S、NaOH溶液
乙方案:稀盐酸、Na2SO4溶液、H2S、NaOH溶液
丙方案:NaCl溶液、Na2SO4溶液、NaOH溶液、Na2S溶液
丁方案:Na2S溶液、Na2SO4溶液、NaCl溶液、NaOH溶液
试回答:
(1) 你认为可行的方案是__________方案,反应的离子方程式有:__________________。
(2)方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚 再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥ 根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是 ;
(2)指出实验步骤中存在的错误并改正: ;
(3)硫酸钠不能放置在空气中冷却的原因是 ;
(4)步骤⑤的目的是 ;
(5)下面的情况有可能造成测试结果偏高的是 (填序号)。
| A.试样中含有加热不挥发的杂质 | B.试样中含有加热易挥发的杂质 |
| C.测试前试样已有部分脱水 | D.实验前坩埚未完全干燥 |
E.晶体加热脱水不完全 F.加热时有晶体溅出
某溶液中含有Ba2+、Cu2+、Ag+、Mg2+等四种金属阳离子,现欲将这四种阳离子逐一沉淀下来。某学生设计了如下四种方案。所选试剂及顺序如下:
甲方案:Na2SO4溶液、稀盐酸、H2S、NaOH溶液
乙方案:稀盐酸、Na2SO4溶液、H2S、NaOH溶液
丙方案:NaCl溶液、Na2SO4溶液、NaOH溶液、Na2S溶液
丁方案:Na2S溶液、Na2SO4溶液、NaCl溶液、NaOH溶液
试回答:
(1) 你认为可行的方案是__________方案,反应的离子方程式有:__________________。
(2)方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
方案__________不可行的原因是:________________________________________。
以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚 再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥ 根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是 ;
(2)指出实验步骤中存在的错误并改正: ;
(3)硫酸钠不能放置在空气中冷却的原因是 ;
(4)步骤⑤的目的是 ;
(5)下面的情况有可能造成测试结果偏高的是 (填序号)。
| A.试样中含有加热不挥发的杂质 | B.试样中含有加热易挥发的杂质 |
| C.测试前试样已有部分脱水 | D.实验前坩埚未完全干燥 |
E.晶体加热脱水不完全 F.加热时有晶体溅出
以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高。其主要流程如下: 
试回答下列问题:
(1)已知反应Ⅰ中发生的主要反应为:Na 2SO 4(s)+4C(s)= Na 2S  (s)+4CO(g)△H="+569.99" kJ/mol,欲使该反应发生并维持该反应进行的条件是 。
(s)+4CO(g)△H="+569.99" kJ/mol,欲使该反应发生并维持该反应进行的条件是 。
(a)常温(b)常温,并通入少量CO 2(c)高温,并通入适量的O 2
(2)配平反应Ⅱ的化学方程式: □Na 2S+□Na 2CO 3+□SO 2=□N  a 2S 2O 3+□CO 2
a 2S 2O 3+□CO 2
(3)反应Ⅲ温度需控制在35~40℃的较低温度,其主要原因是 。
(4)在摩尔盐溶液中加入一种物质的溶液可使NH 4 +、Fe 2  +、SO
+、SO  都大量减少,该物质是 。
都大量减少,该物质是 。