(10海南45)气焊和气割都需要用到乙炔。乙炔俗称电石气(化学式为C2H2),是一种无色无味的气体,密度比空气略小,难溶于水。实验室常用块状固体碳化钙与水反应制备乙炔,该反应比二氧化锰催化过氧化氢分解更加剧烈。请回答:
(1)乙炔的物理性质之一是 ;
(2)图中仪器a的名称是 ;
(3)从下图选择实验室制备乙炔所用仪器的最佳组合是 (填序号)。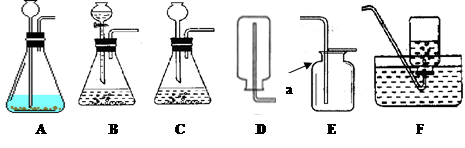
某学习小组在整理化学试剂时,发现一瓶盛有白色固体的试剂瓶,标签破损(如图)。
【提出问题】该白色固体的成分是什么?
【搜集资料】①经老师回忆,该试剂的酸根离子可能是CO32-、SO32-、SO42-、
NO3-中的一种 ②SO2是一种无色有刺激性气味的气体,密度比空气大,易溶于水,能使澄清的石灰水变浑浊,也能使品红溶液褪色,而CO2不能使品红溶液褪色。
【猜想假设】该试剂一定不是,可能是Na2CO3,也可能是或。
【实验探究】
| 实验操作 |
现 象 |
结 论 |
| 取少量白色固体加入适量盐酸 |
产生气泡 |
该白色固体不可能是 |
| 产生的气体通入澄清石灰水 |
石灰水变浑浊 |
该白色固体不可能是 |
| 产生的气体通入品红溶液 |
溶液褪色 |
【获得结论】该白色固体是。
【交流反思】
(1)SO2和CO2均属于非金属氧化物,某些性质相似。请写出下列化学反应方程式:
SO2通入澄清石灰水;
SO2通入紫色石蕊试液,试液变红色。
(2)亚硫酸钠与盐酸反应能生成SO2,实验室中收集SO2的方法为,
检验SO2的试剂为。
某化学小组参观制碱厂后,绘制了该厂生产纯碱的工艺流程图如下,据图回答:
(1)流程Ⅰ是依次向粗盐水中加入Ca(OH)2和Na2CO3,二者加入的顺序能否颠倒?为什么?。
(2)用一个化学反应方程式表示出流程Ⅱ中发生的总反应。
(3)如果不将氯化铵作为目标产品,即加入氨气不是为了生产出氯化铵,那么,氨气在制碱过程中的作用是。
(4)工业生产纯碱的流程中,碳酸化时溶液中析出碳酸氢钠而没有析出氯化铵的原因是。
在初中化学中,我们学习了溶液的有关知识。如图是KNO3的溶解度曲线。
(1)从图中溶解度曲线可以得到的信息是(写一条)。
(2)小明参照图示在常温20 ℃时进行了如下实验:
小明观察到A中所加固体全部溶解,则B中的现象是。上述实验过程中属于不饱和溶液的是(填字母)。D中溶液的溶质质量分数是。
淡水资源的缺乏已成为制约社会发展的重要因素,从浩瀚的海洋里获取淡水,对解决淡水危机具有重要意义。某小组针对这一现状提出问题,并在实验室进行了以下探究。
【提出问题】。
【实验用品】酒精灯、试管、单孔橡皮塞、玻璃导管、铁架台、烧杯、胶头滴管、海水、硝酸银溶液。
【实验过程】
①按如图所示组装仪器并检查装置气密性。
②向大试管中加入5 mL~10 mL海水,塞好橡皮塞,用酒精灯加热。加热一段时间后,小试管内收集到很少液体,试管口有大量白雾。
该小组同学建议对该装置进行改进,你认为改进的措施为:。
③向小试管里的冷凝水中滴加几滴硝酸银溶液,现象为: 。
【得出结论】
通过上述实验探究,你得出的结论是:。
【反思交流】
①对海水淡化后剩余资源,请提出一种合理利用的措施: 。
②“蒸馏法淡化海水”的思路是想办法将水从混合物中分离出来。请列举一种与上述原理相同的混合物分离的例子:。
在研究酸和碱的化学性质时,某小组同学想证明:稀硫酸与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案的设计、实施和评价。
(1)方案一:①测定稀硫酸与NaOH溶液混合前后的pH。测定某NaOH溶液的pH,pH7(选填“<”“>”或“=”)。
②将一定量的稀硫酸加入该NaOH溶液中,混合均匀后测定其pH,pH<7。
③结论:稀硫酸与NaOH溶液发生了化学反应,并且过量。
(2)方案二:观察。(根据图示实验步骤,概括方案要点)
结论:稀硫酸与NaOH溶液发生了化学反应,反应的化学方程式为。
(3)上述两个方案在设计思想上的相同点是。