【10新疆19】.化学兴趣小组的同学分成甲、乙两组对溶液的鉴别进行探究,请你分析并填空。
【实验目的】Na2CO3溶液、NaOH溶液、Ca(OH)2溶液、稀盐酸四种溶液的鉴别。
【实验药品】未贴标签的四瓶溶液[Na2CO3溶液、NaOH溶液、Ca(OH)2溶液、稀盐酸]和紫色石蕊试剂。
【实验仪器】试管、胶头滴管等。
【设计并实验】甲组同学利用紫色石蕊试剂鉴别四种溶液:
| 实验操作和步骤 |
实验现象与结论 |
| (1)用4支试管,各取少量四种溶液,分别滴加紫色石蕊试剂; |
一支试管中溶液由无色变红色,则原溶液是 溶液。 |
| (2)另用3支试管,各取少量未确定的三种溶液,分别滴加步骤(1)检验出的溶液。 |
一支试管中溶液有气泡放出,则原溶液是 溶液 |
| (3)另用2支试管, |
一支试管溶液中有白色沉淀析出,则原溶液是 溶液,另一支试管溶液中无现象,则原溶液是 溶液。 |
乙组同学经讨论认为,不用紫色石蕊试剂也能鉴别出四种溶液。种自分别做了如下实验:
| 同学 |
实验操作 |
实现现象 |
结 论 |
| 小红 |
用3支试管,各取少量三种溶液,分别滴加另一种溶液。 |
一支试管溶液中有气泡放出,其余两支试管溶液中无现象。 |
所滴加的溶液是稀盐酸。 |
| 小勇 |
一支试管溶液中有白色沉淀析出,其余两支试管溶液中无现象。 |
所滴加的溶液是Na2CO3溶液。 |
|
| 小新 |
三支试管溶液中都无现象。 |
所滴加的溶液是NaOH溶液 |
乙组三位同学经过交流后发现本组 同学的结论是错误的,所滴加的溶液应是 溶液,由此鉴别出了四种溶液。
【反应与体会】①物质的鉴别有多种方法;②鉴别物质的关键是利用物质的特征性质等
某学习小组在如图所示的化学药品柜中发现一瓶标签模糊不清的无色溶液,已知这瓶溶液是以下5瓶溶液中的一种:
溶液、
溶液、
溶液、
溶液、
溶液。
(1)根据上述信息判断,该无色溶液不可能是溶液和溶液,只可能是其他3种溶液中的一种。
(2)为了进一步确定该溶液是何种溶液,请你设计实验方案,叙述实
验操作、预期现象与结论。
限用试剂:稀
、
溶液、
溶液、酚酞溶液
| 实验操作 |
预期现象与结论 |
某同学在实验室用以下装置制备氧气并探究氧气的性质。
(1)该同学制备氧气是应选用的药品是(限选:
溶液、
、
),生成氧气的化学方程式为。
(2)夏天室温很高的时候,检验该装置气密性的合理方法是:将导管口放入水面下,然后,若导管口有气泡冒出,说明装置不漏气。
(3)添加药品,连接仪器,加热试管后导管口有气泡冒出,此时导管口还在集气瓶外面,接下来的操作正确的是(填字母)。
| A. |
立刻将导管口移入集气瓶 |
B. |
等到气泡连续且均匀时,再将导管口移入集气瓶 |
C. |
立即熄灭酒精灯,将导管口移入集气瓶后再点燃酒精灯 |
(4)该同学用坩埚钳夹取一小块木炭加热到发红后,伸进一瓶氧气中,观察到的现象是。进一步证明木炭与氧气发生了化学反应的方法是。
实验室需配置一定浓度的硝酸钾溶液。
(1) 查阅硝酸钾溶解性。由右图可知,20℃时,硝酸钾的溶解度为g,在该温度下配制硝酸钾溶液,溶质质量分数最大为%(计算结果保留整数)。
(2)计算。配置40g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为g,所需蒸馏水的体积为mL(水的密度近似看做1g/mL)。
(3)称量。分别在天平左右两盘放上纸片,调节平衡后,(填字母)。
A、先移动游码到所需位置,再添加硝酸钾直到天平平衡
B、先添加所需的硝酸钾,再移动游码直到天平平衡
(4)量取。量取所需蒸馏水要用到的仪器是(填字母)。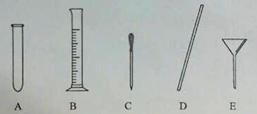
(5)溶解。将称量好的硝酸钾和蒸馏水混合溶解。
(6)稀释。20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液。从下表中找出需要用到的数据:g/mL。
硝酸钾溶液的密度(单位1g/mL)
 温度/℃ 温度/℃质量分数/% |
20 |
40 |
60 |
| 4 |
1.023 |
1.016 |
1.007 |
| 10 |
1.063 |
1.054 |
1.044 |
四氧化三铁可用于医疗器械、电子等工业。某实验兴趣小组从工厂采集废液(含
和少量
、
),进行四氧化三铁的制备实验。
【阅读资料】
(1)25℃时,去氧化物沉淀的pH范围如表。
|
|
|
|
|
| 开始沉淀的pH |
5.7 |
7.6 |
10.4 |
| 沉淀完全的pH |
8.0 |
9.6 |
12.4 |
(2)25℃时,
可溶于pH>10.5的碱溶液。
(3)制备
的实验流程如下:
【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为(写一个即可)。
(2)操作a的名称为。该操作需要的玻璃仪器有烧杯、玻璃棒、等。玻璃棒在此操作中的主要作用是。
(3)溶液1所含溶质有(至少写两种);溶液3所含溶质的主要成分为。
(4)该实验取废液100g,最终得到产品四氧化三铁质量为3.48g,则原废液中硫酸亚铁溶质的质量分数不低于(精确到0.01%)。
结合图所示实验装置回答问题:
(1)实验室若用高锰酸钾制取氧气,可选用的发生和收集装置是(填标号),反应的化学方程式为。
(2)检查装置B气密性的方法是。
(3)装置B与C组合,可以制取的一种气体是,反应的化学方程式为,能用装置C收集该气体的原因是。
(4)一种洗气装置如图所示,为了除去二氧化碳中混有的少量水分,气体应从(填"a"或"b")端导管口通入。
(5)用澄清石灰水检验二氧化碳的化学方程式为。