实验室提供了以下仪器,请你随某兴趣小组的同学一起来参加实验探究活动:

|
(1)若用氯酸钾和二氧化锰来制取氧气,你认为除需要用到上面的⑥⑦⑩仪器外,还需上面的仪器有 (填序号)。
 上述所有仪器选择的依据是 (填字母)。
上述所有仪器选择的依据是 (填字母)。



 乙同学也设计了一种检验该装置气密性的方法,请你帮助完成:关闭活塞,在集气瓶中加水浸没导管末端, ,若集气瓶中导管水柱上升一段时间不下降,则气密性好。
乙同学也设计了一种检验该装置气密性的方法,请你帮助完成:关闭活塞,在集气瓶中加水浸没导管末端, ,若集气瓶中导管水柱上升一段时间不下降,则气密性好。

为探究空气的组成,小明用下图A所示装置进行实验。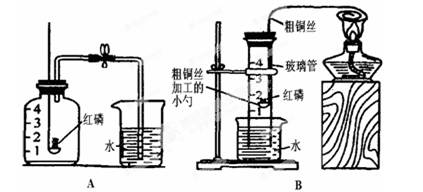
(1)实验时,取下橡胶塞,点燃红磷后迅速伸入集气瓶中并旋紧橡胶塞,这时看到的现象是:_______________,该反应的符号表达式为_____________。
(2)小明又设计了如上图B所示的改进装置,其优点是:___(只需写一点)。从理论上分析,玻璃管内液面最终将上升至__处(填“1”、“2”、“3”、“4”),但实测结果液面往往偏低,其原因可能是:_______(只需写一条)。
(3)从课本镁条燃烧实验小明得到启发,于是他用镁代替红磷做起了这个实验,实验完毕,冷却后进入集气瓶中水的体积远大于总容积的1/5,若装置气密性良好,则可能原因是:_。
某兴趣小组同学探究影响双氧水分解速度的某种因素和验证质量守恒定律实验时,数据记录如下:
| 双氧水的质量 |
双氧水的浓度 |
MnO2的质量 |
相同时间内产生O2体积 |
|
| Ⅰ |
50.0g |
1% |
0.1g |
9 mL |
| Ⅱ |
50.0g |
2% |
0.1g |
16 mL |
| Ⅲ |
50.0g |
4% |
0.1g |
31 mL |
(1)本实验中,测量O2体积的装置是(填编号)。
(2)实验结论:在相同条件下,双氧水的浓度越(选填“大”或“小”),双氧水分解得越快。
(3)小王同学用下图装置进行实验,通过比较也能达到实验目的。
(4)小张同学看到电子天平数据比混合之前数据减小了,他认为该反应不遵守质量守恒定律。你认为他的看
法(填正确或错误),原因是
在一次化学实验探究活动中,老师交给某学习小组一瓶由碳酸钠溶液与澄清石灰水混合反应后,并经过滤得到的无色滤液,要求对该无色滤液中溶质的成分进行探究.请你一同参与他们的探究活动.
【提出猜想】滤液中溶质的成分有如下几种可能:
| A.NaOH | B.Na2CO3、Ca(OH)2、NaOH |
| C.Na2CO3和NaOH | D._________ |
【讨论交流】(1)上述猜想中,肯定不成立的是_________(填猜想序号),其理由是_________.
(2)若猜想A成立,则原反应中碳酸钠溶液与澄清石灰水一定_______(填“是”或“不是”)恰好完全反应.
【实验探究】甲、乙两同学为了验证各自的猜想,分别进行了如下实验:
| 实验操作 |
实验现象 |
实验结论 |
|||||
| 甲同学 |
取少量滤液于试管中, 加入足量的 _________ 溶液 |
有气泡产生 |
猜想 _________ 成立 (填猜想序号) |
||||
| 乙同学 |
取少量滤液于试管中, 加入足量的Na2CO3溶液 |
无明显实验现象 |
猜想A成立 |
||||
甲同学取少量滤液于试管中,加入足量的 _________ 溶液 有气泡产生,猜想 _________ 成立(填猜想序号)
乙同学取少量滤液于试管中,加入足量的Na2CO3溶液 无明显实验现象,猜想A成立
【反思与评价】经过讨论,大家一致认为乙同学的实验结论不一定正确,其理由是:除猜想A可能成立外,猜想 _________ 也可能成立(填猜想序号)。
小芳设计了如下气体制取与性质验证的组合装置。打开分液漏斗活塞放出一定量过氧化氢溶液后,关上活塞,A中出现大量气泡,B中白磷燃烧,C中液面下降,稀盐酸逐渐进入D中。请看图回答问题: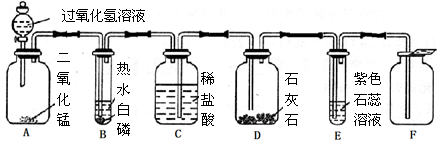
(1)A中发生反应的化学方程式为。
(2)B中白磷能够在水下燃烧的原因是。
(3)D中发生反应的化学方程式为。
(4)E中的实验现象是。
(5)用F装置收集气体的依据是。
(6)实验室用块状固体碳化钙与水反应,制取乙炔(C2H2)气体,该反应比二氧化锰催化过氧化氢分解更加激烈,下列供选的气体发生装置中最合适的是:(填字母)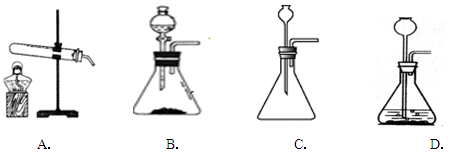
实验室常用石灰石和稀盐酸制取二氧化碳。
探究一气体发生装置的选择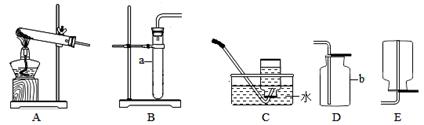
(1)写出图中带标号仪器的名称:a;b。
(2)实验室制取二氧化碳气体,发生和收集装置分别选用和(填字母),
检验集满的方法是。
探究二药品的选择
小明对三组药品进行了研究,实验记录如下:
| 组别 |
药品 |
实验现象 |
| ① |
块状石灰石和稀盐酸 |
产生气泡速率适中 |
| ② |
块状石灰石和稀硫酸 |
产生气泡速率缓慢并逐渐停止 |
| ③ |
粉末状石灰石和稀盐酸 |
产生气泡速率很快 |
对照实验①③,是探究对产生二氧化碳速率的影响;
对照实验,是探究不同的酸对产生二氧化碳速率的影响;
小明选择第①组药品来制取二氧化碳,该组反应的化学方程式为;
探究三生成二氧化碳量的测定
实验室常通过下列两种途径测量生成二氧化碳的量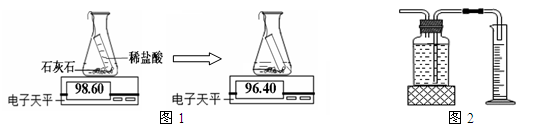
途径一(如图1):由图可知产生二氧化碳的质量为g。
途径二(如图2):通过排水法测得生成二氧化碳的体积。
由上两种途径比较,你认为哪种途径实验结果更为准确,理由是 。