学习了酸、碱、盐的化学性质后,某小组同学在实验室做了如下探究实验,请根据实验回答下列问题。
查阅资料信息:①氯化钡溶液和硫酸钠溶液均为中性溶液
②碳酸钡为白色沉淀
③硫酸钡不与酸反应
(1)将酚酞溶液滴入到碳酸钠溶液中,发现溶液变红,说明碳酸钠溶液显 (填“酸性”、“碱性”或“中性”)。
(2)如图所示,用胶头滴管将氯化钡溶液滴入到锥形瓶中,观察到有白色沉淀产生,液体呈红色,写 出该反应的化学方程式 。
(3)打开分液漏斗的活塞,继续向锥形瓶中滴入稀硫酸,观察到锥形瓶内有气泡产生并有白色沉淀,液体呈无色。试管内澄清的石灰水变浑浊,写出试管内反应的化学方程式 。
(4)实验结束后,小组同学将锥形瓶中的物质过滤,继续探究滤液中溶质的成分(酚酞除外),认为一定含有的溶质是 ,可能含有的溶质是 。
(5)设计实验,验证可能含有的溶质是否存在。请完成下列实验报告。
实验步骤 |
实验现象 |
实验结论 |
取滤液少许于试管中,加入 。 |
|
可能含有的溶质存在 |

【2015年广西省桂林市】在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
| 实验序号 |
滴加CuSO4溶液的量 |
实验现象 |
| ① |
第1~6滴 |
产生蓝色沉淀,但震荡后沉淀消失,形成亮蓝色溶液 |
| ② |
第7~9滴 |
产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
在实验①中同学们根据所学初中化学知识判断蓝色沉淀是氢氧化铜,请你写出生成蓝色沉淀的化学方程式 。
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究。
【查阅资料】
I.氢氧化铜在室温下温度,70℃—80℃时可脱水分解生成氧化铜
II.铜酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色。
【猜想与讨论】
小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解。其他同学一致否定了他的猜测,理由是 。
同学们交流讨论后,提出以下两种猜想。
猜想一:少许氢氧化铜可溶于足量水中。
猜想二:氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色。
【实验探究】
为验证猜想,同学们用氢氧化铜粉末(其它试剂可任选)设计如下实验。请你填写表中的空格。
| 实验序号 |
实验方法与操作 |
实验现象 |
结论 |
| ③ |
将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 |
|
猜想一错误 |
| ④ |
|
|
猜想二正确 |
【结论与反思】
(1)根据实验,并进一步查阅资料知道,氢氧化铜在氢氧化钠溶液中溶解生成Na2Cu(OH)4,反应的化学方程式是 。
(2)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是 。
【2015年海南省】某化学兴趣小组同学为了探究实验室中的氢氧化钠固体是否变质,进行了有关实验。请你与他们一起完成以下探究活动:
【猜想】
猜想I: 没有变质;猜想Ⅱ:已经变质;
【实验和推断】
(1)加入的适量 A 溶液是(填名称),若现象a为有气泡产生,则说明氢氧化钠已经变质。
(2)若现象b为 ,说明氢氧化钠没有变质。
【反思】氢氧化钠的保存方法是 (填“A”或“B”)。A.密封保存B.不需密封保存
【2015年湖北省鄂州市】某食品包装袋中有一个小纸袋,上面写“生石灰干燥剂,请勿食用”。该食品已放置两月有余。请你对下列问题进行探究。
(1)小纸袋中的物质能否继续作干燥剂?
| 实验步骤 |
实验现象 |
结论 |
| 取足量的小纸袋中的固体放入烧杯中,加入适量的水,触摸杯壁 |
可继续作干燥剂 |
(2)猜想:小纸袋中的物质除含有CaO外,还可能含有Ca(OH)2和 ;
(3)请设计实验证明(2)中你所填的物质是否存在。
【2015年湖北省荆州市】某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
【猜想与假设】其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
【资料查阅】上述四种物质的相关信息如下:
| 物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
| 常温下的溶解度/g |
36 |
109 |
21.5 |
9.6 |
| 常温下某稀溶液的pH |
7 |
13 |
11 |
9 |
【探究过程】
如图乙所示,在操作①后可确定溶质不是NaCl,则其实验现象应是 ;
在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的 。
【探究结论】
你认为该溶液中的溶质可能是上述假设物质中的 ,
你的判断依据是 。
【探究反思】
(1)若上述探究结论是正确的,操作②产生的气体应是 (写化学式),
实验室检验该气体的实验操作及现象是 。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由:
【2015年广东省佛山市】硫酸铵和氯化钾是化工生产的副产品,直接作为肥料使用会使土壤酸化或影响作物的生长,工业上往往将氯化钾转化为无氯钾肥。下图是硫酸铵等几种盐的溶解度曲线。回答下列问题: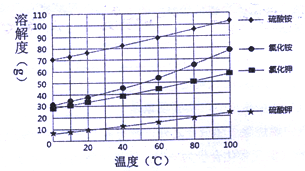
(1)根据溶解度曲线图,归纳硫酸铵等物质溶解度——温度曲线变化规律:
① ;
②温度相同时, 。
(2)将氯化钾转化为无氯钾肥的流程如下:
③根据溶解度曲线判断产品(无氯钾肥)的化学式是 ;
④操作Ⅰ主要是趁热过滤,过滤后的产品中 (NH4)2SO4晶体析出(填“有”或“没有”)。
(3)苯甲酸(C6H5COOH)通常用作定香剂或防腐剂,也用作果汁饮料的保香剂。合成苯甲酸晶体常伴随有氯化钾等副产品生成,某同学加热分离氯化钾后的白色固体A,并测定其熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔。
资料:苯甲酸熔点122.4℃;纯净固体一般都有固定熔点;在常温时苯甲酸溶解度很小,小于0.4 g。
【提出问题】分离氯化钾后的白色固体A的成分是什么?
【猜想】猜想1:苯甲酸;猜想2:氯化钾;猜想3: ⑤ 。
【实验探究】限选试剂:蒸馏水、AgNO3溶液、稀硝酸。
| 实验操作 |
实验现象 |
实验结论 |
| Ⅰ将白色固体A加入水中,加热、溶解、冷却、过滤。 |
得到白色晶体和无色滤液 |
|
| Ⅱ取无色滤液少许于试管中, ⑥ 。 |
⑦ 。 |
白色固体A中含有KCl。 |
| Ⅲ取白色晶体, ⑧ 。 |
熔点是 ⑨ 。 |
结合实验Ⅱ,猜想3成立。 |