1)有右下图所示A、B、C、三种仪器:
请写出三种仪器的名称
A B C
A______________B______________C_____________
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是________,烧杯的实际质量______ g。
g。
(3)指出下面3个实验中各存在的一个错误:
A__________________________,
B__________________________,
C__________________________。
(4)Fe(OH)3胶体制备的操作是
________________________________________________________
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO•Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 2NaAlO2 +CO2↑;
2NaAlO2 +CO2↑;
③Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是 _。
(2)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr207 + 2KCl=K2Cr207 ↓+ 2NaCl,该反应在溶液中能发生的理由是 _
(3)操作III有多步组成,获得K2Cr207晶体的操作依次是:加入KC1固体、蒸发浓缩、 _、过滤、 _、干燥。
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量 _ (填写试剂)、溶解、过滤、再通入足量 _气体.......灼烧、冷却、称量,得干燥固体m g。计算祥品中氢氧化铝的质量分数为 _ (用含m、n的代数式表示)。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min。然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2SO3标准溶液滴定若实验中共用去Na2S203标准溶液47.40mL,则所得产品中重铬酸钾的纯度为 _。(保留3位有效数字)
已知:①K2Cr2O7的摩尔质量为294g/mol
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-
(10分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析,该同学改用图二的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快。
(1)若锥形瓶内装的是亚硫酸钠,写出锥形瓶内反应的化学方程式:
________________________________________________________________________。
(2)对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是________________________________________________________________________。
写出此时试管内发生反应的总化学方程式:__________________________________。
(3)用图二装置实验时,以相同速率通入CO2或SO2,SO2产生浑浊再变澄清的现象比CO2快,其原因是______________________________________________________________。
(4)用图一进行SO2与石灰水反应的实验时,为防止SO2污染空气,应用盛有过量浓烧碱溶液的容器吸收SO2,写出容器内发生反应的离子方程式:
________________________________________________________________。
(13分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。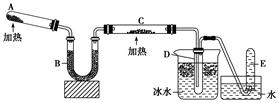
(1)A中装有Ca(OH)2和NH4Cl混合粉末,该反应的化学方程式是
________________________________________________________________________。
(2)B中加入的是碱石灰,其作用是___________________________________________。
(3)实验时在C中观察到的现象是________________________________________,
发生反应的化学方程式是:_____________________________________________。
(4)D中收集到的物质是________,检验该物质的方法和现象是_______________________。
(NH4)2Fe(SO4)2·6H2O俗名摩尔盐,价格便宜,可用来净水或治疗缺铁性贫血等,是一种重要的化工原料。
(1)摩尔盐的水溶液呈色。
(2)c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是。
(3)甲乙两位同学想测定一瓶摩尔盐的纯度。甲同学设计的实验装置如下图: 。
。
从上图推断甲同学想通过测定计算摩尔盐的纯度。该方案的不足之处在于。
(4)乙同学在甲同学的基础上做了改进,其实验装置如下图: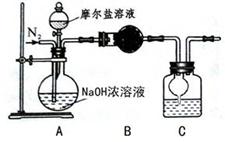 。
。
则B与C中的试剂分别是和。C中干燥管的作用是。乙同学称取了 10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重 0.68g,则依此数据推算这份摩尔盐的纯度为%(答案精确到小数点后第一位)。
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点。
图10、图11分别是实验室模拟合成氨及氨催化氧化的装置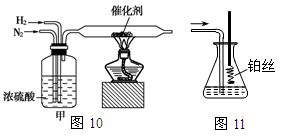
(1)氮气和氢气通过图10装置,该装置中浓硫酸的作用是控制气体流速和。
(2)用图11装置吸收一段时间氨后,再通入空气,同时将已经加热的铂丝插入乙装置的锥形瓶内,铂丝保持红热的原因是,写出该装置中氨氧化的化学方程式。反应结束后锥形瓶内的溶液中含有H+、OH-、离子、离子。