铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO•Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 2NaAlO2 +CO2↑;
2NaAlO2 +CO2↑;
③Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是 _。
(2)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr207 + 2KCl=K2Cr207 ↓+ 2NaCl,该反应在溶液中能发生的理由是 _
(3)操作III有多步组成,获得K2Cr207晶体的操作依次是:加入KC1固体、蒸发浓缩、 _、过滤、 _、干燥。
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量 _ (填写试剂)、溶解、过滤、再通入足量 _气体.......灼烧、冷却、称量,得干燥固体m g。计算祥品中氢氧化铝的质量分数为 _ (用含m、n的代数式表示)。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min。然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2SO3标准溶液滴定若实验中共用去Na2S203标准溶液47.40mL,则所得产品中重铬酸钾的纯度为 _。(保留3位有效数字)
已知:①K2Cr2O7的摩尔质量为294g/mol
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-
测定1 mol氧气在标准状况下所占体积的实验操作步骤如下:
①按下图装配实验装置。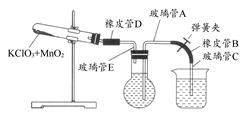
②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置放置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口,一直要在烧杯的水中,不能离开水面,其理由是。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致?。
(3)标准状况下,1 mol氧气所占的体积(保留小数后两位)为L;混合物中MnO2的质量分数为。
Na2SO3、SO2是中学常见的物质。
(1)某同学用下图示装置制取干燥纯净的SO2。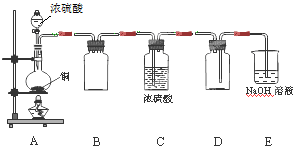
写出制取SO2气体的化学方程式。请指出D装置中的错误。若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是。
(2)向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色。反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告。限选试剂:2 mol/LHCl,1 mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1 mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水。
| 编号 |
实验操作 |
预期现象和结论 |
| 步骤① |
在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色。 |
,证明待测液中含Br-。 |
| 步骤② |
在试管B中加入少量待测液, |
有白色沉淀生成, 证明待测液中含SO42-。 |
| 步骤③ |
在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴______(填试剂),振荡。 |
, 证明待测液中含SO32-。 |
下图是研究铜与浓硫酸的反应装置:
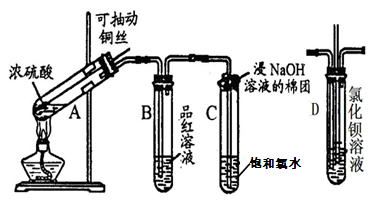
(1)A试管中发生反应的化学方程式为。
(2)反应一段时间后,可观察到B试管中的现象为。
(3)C试管口浸有NaOH溶液的棉团作用是。
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是、。(要求填一种化合物和一种单质的化学式;如有需要,可加装防倒吸装置。)
(5)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是。
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
仅由
| 资料1 |
 附表铜与浓硫酸反应产生黑色物质的相关性质 |
| 资料2 |
X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。 |
上述资料可得出的正确结论是。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L
d.硫酸浓度越大,黑色物质越快出现、越难消失
由下列仪器组成的一套制取SO2并验证它有氧化性、还原性和漂白性。(图中铁架台、铁夹等省略,装置③中E管气体向上流出)②④⑤装置中所用试剂只能从以下物质中选用:氯水、浓H2SO4、溴水、硝酸、品红溶液、烧碱溶液、石灰水。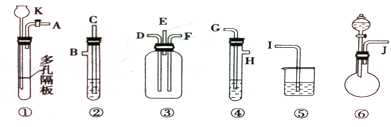
试回答:
(1)连接仪器时,导气管连接顺序从左到右J接_____、_____接_____、H接D、______接I、______接______。
(2)装置②用以检验SO2的还原性,所盛试剂最好是______,装置④中所盛试剂最好是______,装置⑤中所盛试剂最好是_______,目的是
(3)仪器连接好后,怎样检查装置①的气密性,简述操作要点。
(4)书写①装置中反应的化学方程式。
书写③装置中反应的化学方程式。
实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如右:
| 乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g•cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-130 |
9 |
-116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用洗涤除去;
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是。