高氯酸铵样品中 NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装置已略去),实验步骤如下: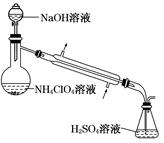
步骤 1:按如图所示组装仪器,检查装置气密性。
步骤 2:准确称取样品a g (约 0.5 g)于蒸馏烧瓶中,加入约 150 mL 水溶解。
步骤 3:准确量取 40.00 mL 约 0.1 mol·L-1 H2SO4溶液于锥形瓶中。
步骤 4:经滴液漏斗向蒸馏烧瓶中加入 20 mL 3 mol·L-1NaOH 溶液。
步骤 5:加热蒸馏至蒸馏烧瓶中剩余约 100 mL 溶液。
步骤 6:用新煮沸过的水冲洗冷凝装置 2~3 次,洗涤液并入锥形瓶中。
步骤 7:向锥形瓶中加入酸碱指示剂,用 c mol·L-1NaOH 标准溶液滴定至终点,消耗 NaOH 标准溶液 V1 mL。
步骤 8:将实验步骤 1~7 重复 2 次。
①步骤 3中,准确量取 40.00 mL H2SO4溶液的玻璃仪器是 。
②步骤 1~7 中,确保生成的氨被稀硫酸完全吸收的实验步骤是 (填步骤序号)。
③为获得样品中 NH4ClO4的含量,还需补充的实验是 。
草酸晶体的组成可用H2C2O4·XH2O表示,为了测定x值进行如下实验:
①称取Wg草酸晶体,配成100. mL水溶液
②取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后, 用浓度amol/L的KMnO4溶液滴定,所发生的反应为:
用浓度amol/L的KMnO4溶液滴定,所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O ;
试回答:
(1)实验中不需要的仪器有(填序号)还缺少的仪器有(填名称).
a托盘天平(带砝码,镊子) b滴定管 c 100mL量筒 d 100mL容量瓶
e烧杯 f漏斗 g锥形瓶 h玻璃棒 i药匙 j烧瓶 k滴定管夹
(2)实验中KMnO4溶液应装在式滴定管中,达到滴定终点的现象是
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得x值会(偏大、偏小、无影响)。
(4)在滴定过程中若用去amol/L的KMnO4溶液VmL(已取三次平均值),则所配制的草酸溶液的物质的量浓度为mol/L,由此可计算X的值是.
(5)若滴定终点读数时俯视,则计算的X值可能会(偏大、偏小、无影响)
某同学欲在实验室中完成Fe与水蒸气反应的实验,装置如图甲、乙两种。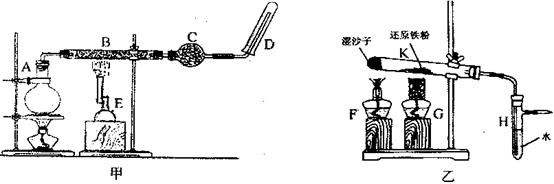
已知B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯。
Ⅰ.对比两装置,回答下列问题:
(1)如何检查乙装置的气密性?。
(2)乙装置中湿沙子的作用是。
(3)B处发生反应的化学方程式:。
(4)该同学认为欲在乙 装置的尖嘴导管处点燃反应产生的气体,装置H必不可少,H的作用是。
装置的尖嘴导管处点燃反应产生的气体,装置H必不可少,H的作用是。
(5)对比甲、乙两装置的B和K,B的优点是。
Ⅱ.某同学为了研究一定时间内铁粉的转化率,用上图中的甲装置设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算铁粉的转化率。
①用排水法收集并测量气体体积可选下图中的装置。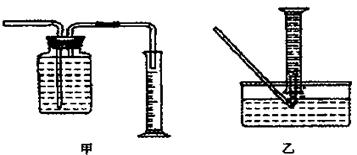
②称取mg铁粉与适量石棉绒混合,然后加热至无气体放出。若收集的气体体积换算为标准状况为VL,铁粉的转化率为(列出计算式即可)。
③为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入足量的盐酸,溶解后过滤,立即向溶液中滴加KSCN溶液,结果观察到溶液的颜色没变化。经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe。他的理由是:。
(共10分)分析下图装置,回答问题:
(1)装置A的烧瓶中发生的反应的化学方程式为,
(2)装置C的直玻管中发生的反应的化学方程式为,
(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是,
(4)装置E中NaOH的作用是,反应的离子方程式为;
(5)B装置的作用很多,除了可以混匀气体外,
还可以:____________________; __________________________________。
为了有效实现NO和NO2的相互转化,设计如下实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。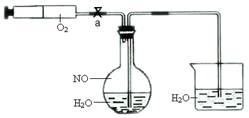
(1)打开止水夹a ,推动针筒活塞,使O2进入平底烧瓶。关上止水夹a ,首先观察到烧瓶中的现象:,
产生此现象的化学反应方程式为:。
(2)轻轻摇动平底烧瓶,观察到烧瓶中的现象为:
①
②
产生此现象的化学反应方程式为 ______________。
1,2 - 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水). 填写下列空白: 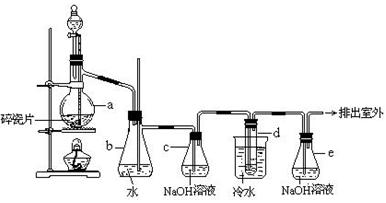
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式
_____________________________________、
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象._________________________________.
(3)容器c中NaOH溶液的作用是:__________________________________.
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多.如果装置的气密性没有问题,试分析其可能的原因(写出一条既可)
___________________________________________________________