1,2 - 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水). 填写下列空白: 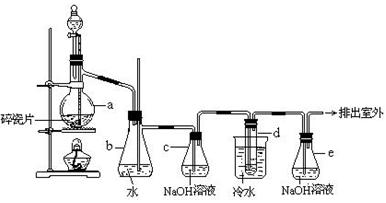
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式
_____________________________________、
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象._________________________________.
(3)容器c中NaOH溶液的作用是:__________________________________.
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多.如果装置的气密性没有问题,试分析其可能的原因(写出一条既可)
___________________________________________________________
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。
Ⅰ.用如图所示装置进行Mg与SO2反应的实验。
(1)选择制取SO2的合适试剂____________________。
①10%的H2SO4溶液②80%的H2SO4溶液③Na2SO3固体④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式______________________________。
装置C中NaOH溶液的作用是____________________________________________。
(3)你认为该装置是否有不足之处?__________。如果有,请一一说明____________________。
Ⅱ.某研究小组进行了“实验室制Si”的研究,他们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si。
②Mg在点燃的条件下即可与SiO2反应。
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4
④Si和SiO2均不与稀H2SO4反应。
⑤SiH4在空气中自燃。
他们在研究报告中记载着:“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……再用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右。”
(4)该小组“实验室制Si”的化学方程式是__________。
(5)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是___________________。
某化工厂排放的污水中含有Al3+、Fe3+、Hg2+、Cu2+四种离子。甲、乙、丙三同学设计从该污水中回收金属铜的方案如下:
甲:污水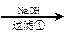
 +++++++++++
+++++++++++
乙:污水
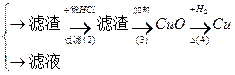
丙:污水
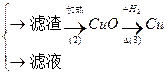
填空和回答:
(1)甲、乙、丙提出的方案能否制得铜?
甲:____________________;乙:____________________;丙:____________________。
(2)在能制得铜的方案中,会导致环境污染的一步操作是:_____________________________
______________________________________________________________________________。
本题中所有的气体体积均为标准状况下的体积。A、B为两种单质,常温下均是固体。在元素周期表中A、B同周期且原子半径A>B。分别取三份质量为1.52 g的A、B的混合物(粉末)进行如下实验:
a.向第一份试样中加入过量的盐酸,充分反应后,放出0.896 L气体,还剩下0.56 g的残渣;
b.向第二份试样中加入过量的10%的NaOH溶液,充分反应后,放出0.896 L气体,还剩下0.96 g的残渣;
c.将第三份试样隔绝空气加强热后,生成一种固体,冷却后,再加入足量的盐酸,该固体全部溶解,产生x L气体。
(1)单质B是__________________。
(2)混合物中A的质量分数是__________________。
(3)写出实验c中有关反应的化学方程式并计算x的值。
某学习小组对炭粉与氧化铁反应产物中气体的成分进行研究。
(1)提出假设:该反应的气体产物全部是二氧化碳(CO2)。
(2)设计方案:将一定量的氧化铁与炭粉的混合物在隔绝氧气的条件下完全反应(如下图),测定参加反应的碳元素与氧元素的质量比。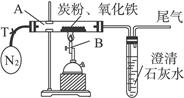
实验装置
(3)查阅资料:N2不与炭粉以及氧化铁发生反应,可用于隔绝氧气进行反应。
(4)实验操作:
①称取5.2 g氧化铁与炭粉的混合粉末,放入48.48 g的玻璃管中,按上图连接后必不可少的实验操作为___________________________________________________。
②加热前,先通一段时间纯净、干燥的氮气,其目的是_____________________________。
③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊,该现象说明_____________________。
④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24克。
(5)数据处理:经计算,参加反应的碳元素质量为0.48克,氧元素质量为0.96克。
(6)得出结论:根据数据处理结果,反应生成的气体为CO和CO2,而且同条件下体积比为1∶1,原假设不成立,理由为__________________________________________________。
(7)该实验反应的化学方程式为_________________________________________________。
在如下图所示的物质转化关系中,A是一种固体单质,E是一种白色不溶物,请完成下列问题:
(1)B的化学式为___________,目前B已被用作_____________________的主要原料。
(2)B和a溶液反应的离子方程式:________________________________________________。
(3)A和a溶液反应的离子方程式:_____________________________________________。
(4)C和过量盐酸反应的离子方程式:___________________________________________。